
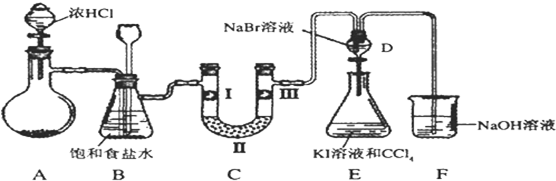
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
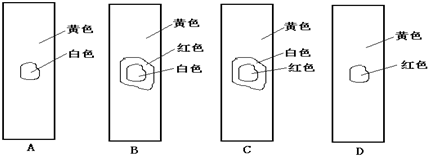
| ||
| ||


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
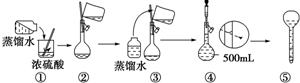
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
| A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
| B | HCl溶液 | 氨水 | 酚酞 | 浅红色→无色 |
| C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
| D | 碘水 | Na2S溶液 | 淀粉 | 无色→蓝色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝作还原剂,氢气做氧化产物 |
| B、该反应属于典型的放热反应 |
| C、如果把该反应设计成原电池,铁、锌均可以做正极 |
| D、标况下,转移2mol 电子,就生成22.4L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3是碱 |
| B、Na2CO3是盐 |
| C、Na2CO3是正盐 |
| D、Na2CO3是钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、V=224 |
| B、样品中Fe的质量为2.14g |
| C、样品中CuO的质量为3.52g |
| D、未氧化前Fe元素的质量分数约为41.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:
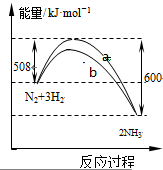
| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com