
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |
分析 加热分解完全残留固体为Na2CO3,失重率为$\frac{30}{136}$×100%≈22.1%,则570℃<T时残留固体的主要成分是Na2CO3,完全分解得到Na2C2O4时,失重率为$\frac{2}{136}$×100%≈1.47%,则T<415℃时反应①、②同时发生,残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率.
解答 解:A.加热完全分解得到Na2C2O4时,失重率为$\frac{2}{136}$×100%≈1.47%<5%,则T<415℃时反应①、②同时发生,故B错误;
B.由A中分析可知,反应①、②可能同时发生,故B错误;
C.加热分解完全残留固体为Na2CO3,失重率为$\frac{30}{136}$×100%≈22.1%,则570℃<T<600℃时,残留固体的主要成分是Na2CO3,故C正确;
D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率,故D错误.
故选:C.
点评 本题考查化学图象有关计算,关键是计算特殊点的失重率进行判断,较好地考查学生分析计算与推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
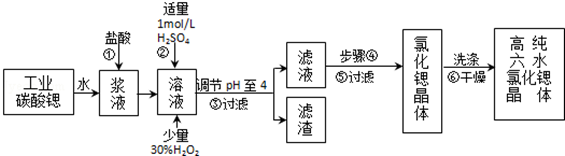
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
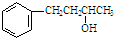 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )| A. |  的名称为3-苯基-2-丙醇 的名称为3-苯基-2-丙醇 | |
| B. | 4-苯基-2-丁醇与 互为同系物 互为同系物 | |
| C. | 4-苯基-2-丁醇分子中的所有碳原子一定共平面 | |
| D. | 4-苯基-2-丁醇的核磁共振氢谱共有8个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O含有2mol氧元素 | |
| B. | 1.8gNH4+中含有的质子数为NA | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和HCl分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
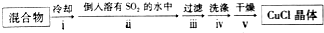
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A.(a-2b-2c) kJ·mol-1
B.(2b+2c-a) kJ·mol-1
C.(b+c-a) kJ·mol-1
D.(a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com