
【题目】a、b、c、d四种短周期元素在周期表中分布如图所示,下列说法正确的是( )

A.若四种元素均为主族元素,则d元素的原子半径最大
B.若b最外层电子占据三条轨道,则a的单质可用于冶炼金属
C.若a为非金属元素,则c的气态氢化物的水溶液可能呈碱性
D.若a最外层有两个未成对电子,则d的单质常温下不可能为气体
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
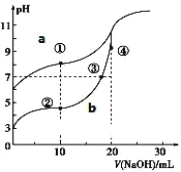
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
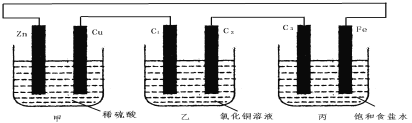
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,萘可被浓硝酸和浓硫酸的混合液硝化生成二硝基化合物,它是1,5二硝基萘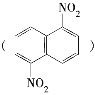 和1,8二硝基萘
和1,8二硝基萘 的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
A.蒸发浓缩结晶B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液D.将滤液缓缓加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.已知:① C(s石墨)+O2(g)=CO2(g) ![]() H1= —393.5mol/L,②C(s金刚石)+O2(g)=CO2(g)
H1= —393.5mol/L,②C(s金刚石)+O2(g)=CO2(g) ![]() H2= —395.0mol/L,则金刚石比石墨稳定
H2= —395.0mol/L,则金刚石比石墨稳定
B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为-285.8kJ·mol-1
C.一定条件下2SO2(g)+O2(g)![]() 2SO3(g) △H1,2SO2(g)+O2(g)
2SO3(g) △H1,2SO2(g)+O2(g)![]() 2SO3(l) △H2则△H1>△H2
2SO3(l) △H2则△H1>△H2
D.在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为 N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键在酸性高锰酸钾溶液中发生断键氧化过程:![]()
![]()
![]() +
+![]()
完成下列填空:
(1)月桂烯是一种常见香料,其结构如图所示![]() 。
。
①月桂烯与等物质的量的Br2发生加成反应,可以得到______种产物。
②月桂烯与酸性高锰酸钾溶液反应时可生成多种有机产物,其中碳原子数最多的一种产物的结构简式为______。
③金刚烷(见图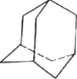 )是月桂烯的一种同分异构体,其一氯代物有______种。
)是月桂烯的一种同分异构体,其一氯代物有______种。
(2)烃X在酸性高锰酸钾溶液中生成等物质的量的丙酮(CH3COCH3)与羧酸Y(C5H10O2),且Y中仅含两种不同化学环境的氢原子,则Y的结构简式是______,X的系统命名为______。
(3)化学式为C8H12的烃Z,在酸性高锰酸钾溶液中生成CH3COCH2COOH,写出Z可能的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
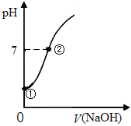
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com