
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Mg2+、NO3﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、OH﹣
C.Mg2+、Ba2+、OH﹣、NO3﹣
D.H+、K+、CO32﹣、SO42﹣
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:
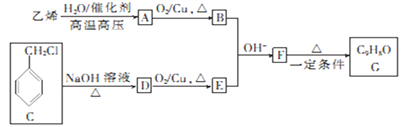
已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含氢原子个数与3.2g O2 所含的分子数相同的是( )
A. 0.2gNH3 B. 0.1mol HCl分子
C. 6.02×1023个H2SO4分子 D. 标准状况下1.12L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知:
1 mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Cl2(g) | HCl(g) |
436 | 243 | 431 |
则:H2(g) + Cl2(g) ![]() 2HCl(g) ΔH=____________________kJ/mol
2HCl(g) ΔH=____________________kJ/mol
(2)已知:乙醇C2H6O的燃烧热为1411.0 kJ/mol,则乙醇燃烧的热化学方程式可表示为_____________________________________________
(3)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9 kJ的热量。热化学方程式可表示为___________________________________________________________________。
(4)已知:① 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 k J/mol
2CO2(g) ΔH2=-566.0 k J/mol
③ H2O(g)![]() H2O(l) ΔH3=-44.0 kJ/mol
H2O(l) ΔH3=-44.0 kJ/mol
甲醇CH3OH燃烧生成一氧化碳和液态水的热化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
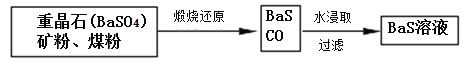
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
D. HS-的电离:HS-+H2O![]() OH-+HS-
OH-+HS-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com