
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A X的氢化物溶于水显酸性
B Y的氧化物是离子化合物
C Z的氢化物的水溶液在空气中存放不易变质
D X和Z的最高价氧化物对应的水化物都是弱酸
科目:高中化学 来源: 题型:
(1)维生素C的结构简式如下图,它的分子式是________。

(2)由于它能防治坏血病,又称为抗坏血酸。维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有________性;在维生素C溶液中滴入少量蓝色有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C具有________性。
(3)用如图所示的实验可以初步比较苹果汁和橙汁中维生素含量的多少。要得出正确的结论,实验过程中不需要控制的条件是________。

A.烧杯的大小必须完全相等
B.烧杯中的淀粉—碘溶液的浓度必须相等
C.胶头滴管滴出的每滴果汁的体积必须相等
D.胶头滴管滴出的滴数必须相等
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2 Cl+Cl ②Cl+H2
Cl+Cl ②Cl+H2 HCl+H ③H+Cl2
HCl+H ③H+Cl2 HCl+Cl……
HCl+Cl……
反应②中形成的化合物的电子式为__________________;反应③中被破坏的化学键属于__________________键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与相邻元素的原子半径从大到小的顺序是__________________ (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第__________________周期__________________族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是__________________。
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b.卤化氢的键长按H—F、H—Cl、H—Br、H—I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如下图。由图推断:
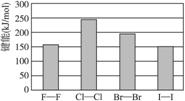
①非金属性强的卤素,其单质分子的化学键__________________断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有_______种,金属性最强的元素与氧反应生成的化合物有______________(填两种化合物的化学式);
(2)属于稀有气体的是_________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是_______________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)____________;
(5)推测Si、N最简单氢化物的稳定性_________大于__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
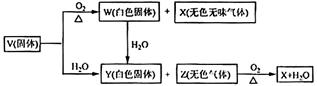
(1)5种化合物分别是V 、W 、X 、Y 、Z :(填化学式)
、Z :(填化学式)
(2)由上述5种化合物中某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A. 第七周期 B.镭 第七周期
第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
查看答案和解析>>
科目:高中化学 来源: 题型:
题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23.(A)
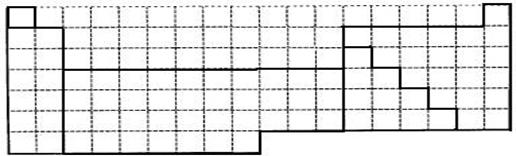
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在下边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____甲、乙的最高价氧化物水化物的酸性强弱为:_____>_____(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_________,请写出元素在元素周期表中的位置与元素原 子结构的关系:
子结构的关系:
___________________________________________________
(B)
下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。
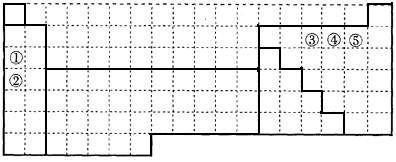
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。
元素③氢化物的电子式为_______。
(3)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
由下列实验事实得出结论不正确的是( )
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性
C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性
D.SO2能使紫红色的酸性高锰酸钾溶液褪色,说明SO2具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com