
【题目】下列关于硅的叙述中,正确的是( )
A. 硅在电子工业中,是重要的半导体材料
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态存在
D. 硅的非金属性比碳强,只有在高温下才能与氢气发生化合反应
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如右下图所示反应关系吸图中“—”相连的两种物质能发生反应)。下列判断一定正确的是

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
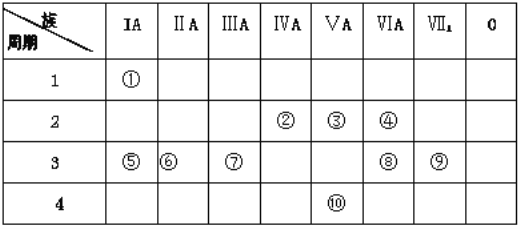
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为合成2-氧代环戊羧酸乙酯K和聚酯L的路线:

已知如下信息:
Ⅰ.链烃A可生产多种重要有机化工原料、合成树脂、合成橡胶等,在标准状况下的密度为1.875g·L-1。
Ⅱ. +R2OH
+R2OH
请回答以下问题:
(1)A的名称是_______,K 中含氧官能团名称为_______。
(2)②的反应类型是_________。
(3)写出反应⑤、⑦的化学方程式:
⑤______________________________________________
⑦______________________________________________
(4)与H官能团的种类和数目完全相同的同分异构体有_______种,其中核磁共振氢谱为4组峰,且峰面积之比为1∶2∶3∶4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料制备(其他试剂任)![]() 的合成路线流程图。 _____________
的合成路线流程图。 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法错误的是( )
A.硅晶体是一种重要的半导体材料,可制作计算机芯片
B.二氧化硅性质稳定,不与任何酸发生反应
C.水泥、玻璃、陶瓷都是硅酸盐产品
D.龙泉青瓷原料[Al2Si2O5(OH)4]用氧化物表示为:Al2O32SiO22H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A. 金属一般都容易导电、导热,具有延展性
B. 金属都具有较高的硬度和密度
C. 所有金属都呈固态
D. 金属单质都能和稀硫酸反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 液氯和氯水都含有氯离子
B. 氯气和液氯都能使干燥的有色布条褪色
C. 盐酸和氯水都含有氯离子
D. 盐酸和氯水都能使湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
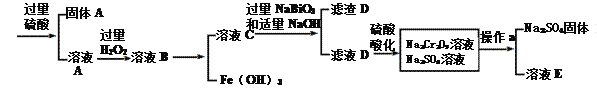
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
③物质溶解度曲线如图所示。
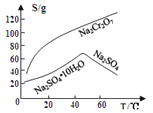
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
【答案】 +6 ![]() 作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
【解析】(1)Na2Cr2O7·2H2O中钠的化合价为+1价,氧的化合价为-2价,氢的化合价为+1价,根据化合物中各元素化合价代数和为0可推出铬的价态为+6价,H2O2的电子式为![]() ;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=
;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=![]() =6.4×10-26,c(OH-)=4.0×10-9,c(H+)=
=6.4×10-26,c(OH-)=4.0×10-9,c(H+)=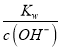 =
=![]() =2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
=2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
【题型】综合题
【结束】
11
【题目】【化学—选修3:物质结构与性质】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅(2814Si)原子中,电子占据的最高能层的轨道数有______个。
(2)已知:蓝色晶体(CuSO4·5H2O)![]() 天蓝色溶液
天蓝色溶液![]() 深蓝色溶液
深蓝色溶液![]() 深蓝色晶体
深蓝色晶体
①蓝色晶体中阴离子的空间构型是_________;
②天蓝色溶液中的阳离子是_____,其配体中心原子的杂化轨道类型是________;
③24.6g深蓝色晶体(其摩尔质量为246g.mol-1)中配离子含有的σ键数是_____;
④实验测得无水乙醇易溶于水,其原因是______________。
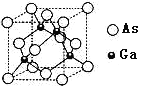
(3)砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料。
①砷化镓属于________晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_________。上述两种晶体中的四种元素电负性最小的是_______(填元素符号)。
②砷化镓晶胞结构如图所示。其晶胞边长为a pm,密度为_______g.cm-3。(砷化镓的摩尔质量为M g.mol-1,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种黄绿色气体,X、Y、Z都是有刺激性气味的气体,M是一种金属单质,D是一种盐,受热易分解。有以下转化关系,部分产物未标出。
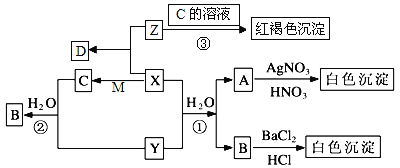
试回答:
(1)写出下列物质的化学式:X________、Y________、M________、D________。
(2)写出下列反应的离子方程式
①_______________________________________,
②_______________________________________,
③_______________________________________。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com