
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
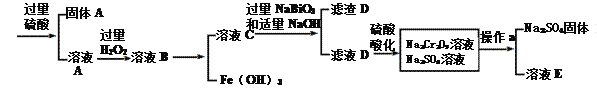
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
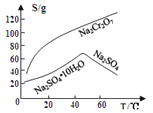
③物质溶解度曲线如图所示。
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
【答案】 +6 ![]() 作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
【解析】(1)Na2Cr2O7·2H2O中钠的化合价为+1价,氧的化合价为-2价,氢的化合价为+1价,根据化合物中各元素化合价代数和为0可推出铬的价态为+6价,H2O2的电子式为![]() ;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=
;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=![]() =6.4×10-26,c(OH-)=4.0×10-9,c(H+)=
=6.4×10-26,c(OH-)=4.0×10-9,c(H+)=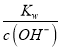 =
=![]() =2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
=2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
【题型】综合题
【结束】
11
【题目】【化学—选修3:物质结构与性质】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅(2814Si)原子中,电子占据的最高能层的轨道数有______个。
(2)已知:蓝色晶体(CuSO4·5H2O)![]() 天蓝色溶液
天蓝色溶液![]() 深蓝色溶液
深蓝色溶液![]() 深蓝色晶体
深蓝色晶体
①蓝色晶体中阴离子的空间构型是_________;
②天蓝色溶液中的阳离子是_____,其配体中心原子的杂化轨道类型是________;
③24.6g深蓝色晶体(其摩尔质量为246g.mol-1)中配离子含有的σ键数是_____;
④实验测得无水乙醇易溶于水,其原因是______________。
(3)砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料。
①砷化镓属于________晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_________。上述两种晶体中的四种元素电负性最小的是_______(填元素符号)。
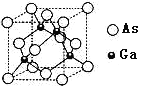
②砷化镓晶胞结构如图所示。其晶胞边长为a pm,密度为_______g.cm-3。(砷化镓的摩尔质量为M g.mol-1,阿伏伽德罗常数为NA)
【答案】 9 四面体 [Cu(H2O)4]2+ sp3 1.6NA 乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子 原子晶体 BN 二者均为原子晶体,B、N间的键长比Ga、As的键长短,键能大 Ga 4Mx1030/a3NA
【解析】(1)基态硅(2814Si)原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9;(2)①蓝色晶体CuSO4·5H2O中阴离子SO42-,根据价层电子对互斥理论,价层电子对个数=σ键+孤电子对个数,SO42-中中心原子S的价层电子对为![]() =4,孤电子对数为
=4,孤电子对数为![]() =0,不含孤电子对,所以空间构型是正四面体结构;②蓝色晶体溶于水得到天蓝色溶液中的阳离子是[Cu(H2O)4]2+;其配体H2O中心原子O原子杂化轨道数为
=0,不含孤电子对,所以空间构型是正四面体结构;②蓝色晶体溶于水得到天蓝色溶液中的阳离子是[Cu(H2O)4]2+;其配体H2O中心原子O原子杂化轨道数为![]() =4,,采取sp3杂化方式;③每个配离子[Cu(NH3)4]2+含有的σ键数是3×4+4=16,故24.6g深蓝色晶体{[Cu(NH3)4]SO4H2O }为0.1mol,其中配离子[Cu(NH3)4]2+含有的σ键数是0.1mol×16×NA mol-1=1.6NA;④乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子,故无水乙醇易溶于水;(3)①砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料,与晶体硅相似,故砷化镓属于原子晶体;氮化硼与砷化镓都属于原子晶体,B、N间的键长比Ga、As的键长短,键能大,故BN晶体熔点较高;非金属性越强,电负性越强,则B、N、Ga、As四种元素电负性最小的Ga;②一个晶胞中含有As 8×
=4,,采取sp3杂化方式;③每个配离子[Cu(NH3)4]2+含有的σ键数是3×4+4=16,故24.6g深蓝色晶体{[Cu(NH3)4]SO4H2O }为0.1mol,其中配离子[Cu(NH3)4]2+含有的σ键数是0.1mol×16×NA mol-1=1.6NA;④乙醇分子与水分子间存在氢键,乙醇分子和水分子都是极性分子,故无水乙醇易溶于水;(3)①砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料,与晶体硅相似,故砷化镓属于原子晶体;氮化硼与砷化镓都属于原子晶体,B、N间的键长比Ga、As的键长短,键能大,故BN晶体熔点较高;非金属性越强,电负性越强,则B、N、Ga、As四种元素电负性最小的Ga;②一个晶胞中含有As 8×![]() +6×
+6×![]() =4个,Ga在内部,共4个,即一个晶胞中含有4个砷化镓,其晶胞边长为apm=a×10-10cm,V=a3×10-30cm3,密度为
=4个,Ga在内部,共4个,即一个晶胞中含有4个砷化镓,其晶胞边长为apm=a×10-10cm,V=a3×10-30cm3,密度为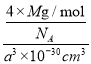 =
=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的叙述中,正确的是( )
A. 硅在电子工业中,是重要的半导体材料
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态存在
D. 硅的非金属性比碳强,只有在高温下才能与氢气发生化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解方程式的书写中,正确的是( )
A.CH3COO﹣的水解方程式:CH3COO﹣+H2O?CH3COOH+OH﹣
B.HCO3﹣的水解方程式:HCO ![]() +H2O?CO
+H2O?CO ![]() +H3O+
+H3O+
C.CO ![]() 的水解方程式:CO
的水解方程式:CO ![]() ?+2H2O?H2CO3+2OH﹣
?+2H2O?H2CO3+2OH﹣
D.Fe3+的水解方程式:Fe3++3OH﹣?Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
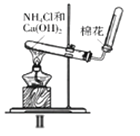
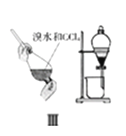
【题目】下列实验装置及说法正确的是( )
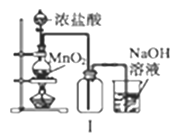
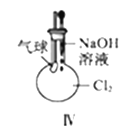
A. Ⅰ图中:实验室制备氯气,若MnO2过量,则浓盐酸可被全部消耗
B. Ⅱ图中:实验室制备氨气,棉花的作用是用来减小空气对流
C. Ⅲ图中:利用CCl4萃取溴,上层为CCl4层
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A.寻找合适催化剂提高合成氨工业中原料的转化率
B.对废旧电池进行回收处理,主要是为了环境保护和变废为宝
C.提高油品质量,可以从一定程度上减少雾霾天气
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH─离子浓度分别为a和b,则a与b的关系为( )
A.a>b
B.a=10﹣4b
C.b=10﹣4a
D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”,“减小”或“不变”).
(填“增大”,“减小”或“不变”).
②若向氨水中加入稀硫酸,使其恰好中和,所得溶液的pH7(填“>”“<”或“=”),用离子方程式表示其原因: .
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42﹣)为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com