
【题目】下列水解方程式的书写中,正确的是( )
A.CH3COO﹣的水解方程式:CH3COO﹣+H2O?CH3COOH+OH﹣
B.HCO3﹣的水解方程式:HCO ![]() +H2O?CO
+H2O?CO ![]() +H3O+
+H3O+
C.CO ![]() 的水解方程式:CO
的水解方程式:CO ![]() ?+2H2O?H2CO3+2OH﹣
?+2H2O?H2CO3+2OH﹣
D.Fe3+的水解方程式:Fe3++3OH﹣?Fe(OH)3
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? 并说明理由:_____。
II.根据下图所示装置图回答以下问题。
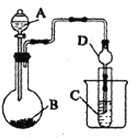
(1)利用如图装置可以验证非金属性的变化规律。图中A装置名称是_______。干燥管D的作用是___________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫: 烧瓶中发生反应的离子方程式为_________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________。
(3)若要用此装置证明酸性: HNO3>H2CO3>H2SiO3进而证明非金属性: N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为______(填序号);试管中发生反应的离子方程式为________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为合成2-氧代环戊羧酸乙酯K和聚酯L的路线:

已知如下信息:
Ⅰ.链烃A可生产多种重要有机化工原料、合成树脂、合成橡胶等,在标准状况下的密度为1.875g·L-1。
Ⅱ. +R2OH
+R2OH
请回答以下问题:
(1)A的名称是_______,K 中含氧官能团名称为_______。
(2)②的反应类型是_________。
(3)写出反应⑤、⑦的化学方程式:
⑤______________________________________________
⑦______________________________________________
(4)与H官能团的种类和数目完全相同的同分异构体有_______种,其中核磁共振氢谱为4组峰,且峰面积之比为1∶2∶3∶4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料制备(其他试剂任)![]() 的合成路线流程图。 _____________
的合成路线流程图。 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A. 金属一般都容易导电、导热,具有延展性
B. 金属都具有较高的硬度和密度
C. 所有金属都呈固态
D. 金属单质都能和稀硫酸反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 液氯和氯水都含有氯离子
B. 氯气和液氯都能使干燥的有色布条褪色
C. 盐酸和氯水都含有氯离子
D. 盐酸和氯水都能使湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
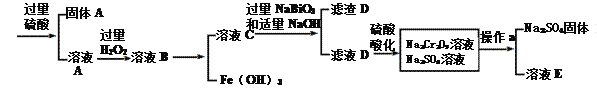
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
③物质溶解度曲线如图所示。
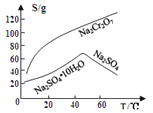
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
【答案】 +6 ![]() 作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
【解析】(1)Na2Cr2O7·2H2O中钠的化合价为+1价,氧的化合价为-2价,氢的化合价为+1价,根据化合物中各元素化合价代数和为0可推出铬的价态为+6价,H2O2的电子式为![]() ;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=
;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=![]() =6.4×10-26,c(OH-)=4.0×10-9,c(H+)=
=6.4×10-26,c(OH-)=4.0×10-9,c(H+)=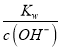 =
=![]() =2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
=2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
【题型】综合题
【结束】
11
【题目】【化学—选修3:物质结构与性质】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅(2814Si)原子中,电子占据的最高能层的轨道数有______个。
(2)已知:蓝色晶体(CuSO4·5H2O)![]() 天蓝色溶液
天蓝色溶液![]() 深蓝色溶液
深蓝色溶液![]() 深蓝色晶体
深蓝色晶体
①蓝色晶体中阴离子的空间构型是_________;
②天蓝色溶液中的阳离子是_____,其配体中心原子的杂化轨道类型是________;
③24.6g深蓝色晶体(其摩尔质量为246g.mol-1)中配离子含有的σ键数是_____;
④实验测得无水乙醇易溶于水,其原因是______________。
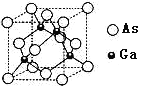
(3)砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料。
①砷化镓属于________晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_________。上述两种晶体中的四种元素电负性最小的是_______(填元素符号)。
②砷化镓晶胞结构如图所示。其晶胞边长为a pm,密度为_______g.cm-3。(砷化镓的摩尔质量为M g.mol-1,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、OH﹣、HS﹣NO3﹣
B.Al3+、Cl﹣、HCO3﹣、Na+
C.AlO2﹣、K+、CO32﹣、Na+
D.Fe2+、K+、H+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某元素在化学反应中由化合态变为游离态,则该元素可能被还原
B.金属原子失电子越多,还原性越强
C.强电解质溶液的导电能力一定比弱电解质强
D.NaHSO4在水溶液中电离时生成的阳离子有氢离子,所以是酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com