
【题目】以下为合成2-氧代环戊羧酸乙酯K和聚酯L的路线:

已知如下信息:
Ⅰ.链烃A可生产多种重要有机化工原料、合成树脂、合成橡胶等,在标准状况下的密度为1.875g·L-1。
Ⅱ. +R2OH
+R2OH
请回答以下问题:
(1)A的名称是_______,K 中含氧官能团名称为_______。
(2)②的反应类型是_________。
(3)写出反应⑤、⑦的化学方程式:
⑤______________________________________________
⑦______________________________________________
(4)与H官能团的种类和数目完全相同的同分异构体有_______种,其中核磁共振氢谱为4组峰,且峰面积之比为1∶2∶3∶4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料制备(其他试剂任)![]() 的合成路线流程图。 _____________
的合成路线流程图。 _____________
【答案】 丙烯 羰基、酯基 取代(水解)反应 ![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O
+NaCl+H2O  (或
(或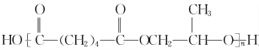 )+(2n-1)H2O 8
)+(2n-1)H2O 8 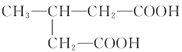 C2H5OH
C2H5OH![]() CH3COOH
CH3COOH![]() CH3COOC2H5
CH3COOC2H5![]()
![]()
【解析】链烃A可生产多种重要有机化工原料,在标准状况下的密度为1.875 g·L-1,则A的摩尔质量为1.875 g·L-1×22.4L=42g/mol,所以A是丙烯,A与氯气加成生成1,2-二氯丙烷(B);B在碱性条件下水解为2-甲基乙二醇(C);苯与氢气发生加成反应生成E,则E是环己烷,环己烷与 氯气发生取代反应生成F,根据F的分子式可知F是![]() ;
;![]() 在氢氧化钠的醇溶液加热条件下发生消去反应生成环己烯G;环己烯被高锰酸钾溶液氧化为己二酸(H);根据反应Ⅱ逆推,J是CH3CH2OOC(CH2)4COOCH2CH3,I是乙醇。
在氢氧化钠的醇溶液加热条件下发生消去反应生成环己烯G;环己烯被高锰酸钾溶液氧化为己二酸(H);根据反应Ⅱ逆推,J是CH3CH2OOC(CH2)4COOCH2CH3,I是乙醇。
(1).根据上述分析可知A为丙烯,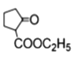 中含氧官能团名称为:羰基、酯基,故答案为:丙烯;羰基、酯基;
中含氧官能团名称为:羰基、酯基,故答案为:丙烯;羰基、酯基;
(2)②是1,2-二氯丙烷在碱性条件下生成2-甲基乙二醇,反应类型是取代(水解)反应,故答案为:取代(水解)反应;
(3). ⑤是![]() 在氢氧化钠的醇溶液加热条件下发生消去反应生成环己烯,化学方程式为:
在氢氧化钠的醇溶液加热条件下发生消去反应生成环己烯,化学方程式为:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;⑦是2-甲基乙二醇和己二酸在一定体积下发生缩聚反应,反应方程式为:
+NaCl+H2O;⑦是2-甲基乙二醇和己二酸在一定体积下发生缩聚反应,反应方程式为: (或
(或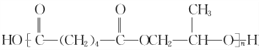 )+(2n-1)H2O,故答案为:
)+(2n-1)H2O,故答案为:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O; (或
(或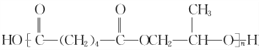 )+(2n-1)H2O;
)+(2n-1)H2O;
(4).与己二酸官能团的种类和数目完全相同的同分异构体有:![]() 、
、![]() 、
、![]() 、
、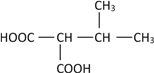 、
、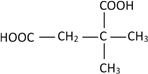 、
、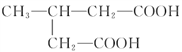 、
、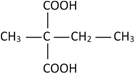 、
、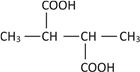 共8种,其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是
共8种,其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是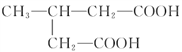 ,故答案为: 8;
,故答案为: 8;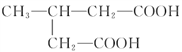 ;
;
(5).以乙醇为原料制备![]() ,先用乙醇制备乙酸,再合成乙酸乙酯,最后根据反应Ⅱ制备
,先用乙醇制备乙酸,再合成乙酸乙酯,最后根据反应Ⅱ制备![]() ,所以合成路线流程图是:C2H5OH
,所以合成路线流程图是:C2H5OH![]() CH3COOH
CH3COOH![]() CH3COOC2H5
CH3COOC2H5![]()
![]() ,故答案为:C2H5OH
,故答案为:C2H5OH![]() CH3COOH
CH3COOH![]() CH3COOC2H5
CH3COOC2H5![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型图正确的是( )
A. H2O2的电子式:![]() B. CO2的比例模型:
B. CO2的比例模型:![]()
C. 质子数与中子数相等的氢原子符号:21H D. HClO的结构式为:H-Cl-O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+ B. AlO2- C. Al(OH)3 D. Al3+和Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示。则下列结论正确的是( )
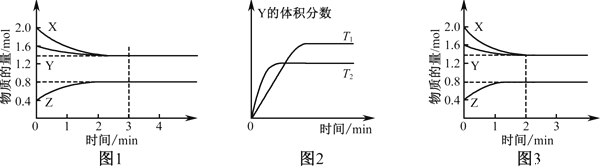
A. 容器中发生的反应可表示为:4X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
C. 升高温度,反应的化学平衡常数K增大
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去苯中所含的苯酚,可采用的适宜方法是( )
A.加70℃以上的热水,分液
B.加适量浓溴水,过滤
C.加足量NaOH溶液,分液
D.加适量FeCl3溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的叙述中,正确的是( )
A. 硅在电子工业中,是重要的半导体材料
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态存在
D. 硅的非金属性比碳强,只有在高温下才能与氢气发生化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解方程式的书写中,正确的是( )
A.CH3COO﹣的水解方程式:CH3COO﹣+H2O?CH3COOH+OH﹣
B.HCO3﹣的水解方程式:HCO ![]() +H2O?CO
+H2O?CO ![]() +H3O+
+H3O+
C.CO ![]() 的水解方程式:CO
的水解方程式:CO ![]() ?+2H2O?H2CO3+2OH﹣
?+2H2O?H2CO3+2OH﹣
D.Fe3+的水解方程式:Fe3++3OH﹣?Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”,“减小”或“不变”).
(填“增大”,“减小”或“不变”).
②若向氨水中加入稀硫酸,使其恰好中和,所得溶液的pH7(填“>”“<”或“=”),用离子方程式表示其原因: .
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42﹣)为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com