
【题目】有机化合物G常用作香料,合成G的一种路线如下:

已知以下信息:
①A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢
②CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
③![]()
回答下列问题:
(1)A的结构简式为____________,D中官能团的名称为____________。
(2)B→C的反应类型为__________。
(3)D→E反应的化学方程式为__________________________________________。
(4)检验M是否已完全转化为N的实验操作是_____________________________________________________________________________________________________________。
(5)满足下列条件的L的同分异构体有____________种(不考虑立体异构),①能发生银镜反应 ②能发生水解反应,③属于芳香族化合物,其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的所有可能结构的结构简式____________________________________。
(6)参照上述合成路线,设计一条以1-丁醇和NBS为原料制备顺丁橡胶
![]() 的合成路线:_____________________
的合成路线:_____________________
【答案】![]() 碳碳双键、氯原子消去反应
碳碳双键、氯原子消去反应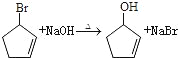 取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N,否则M未完全转化为N14
取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N,否则M未完全转化为N14![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]()
![]()
【解析】由G的结构简式可知E、N分别为![]() 、
、![]() 中的一种,K发生信息③中的转化得到M,M发生催化氧化生成N为羧酸,故N为
中的一种,K发生信息③中的转化得到M,M发生催化氧化生成N为羧酸,故N为![]() ,E为
,E为![]() ,逆推可知M为
,逆推可知M为![]() ,L为
,L为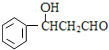 ,K为
,K为![]() .A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢,能与氢气发生加成反应,系列转化得到E,可知A为
.A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢,能与氢气发生加成反应,系列转化得到E,可知A为![]() ,则B为
,则B为![]() ,结合信息②可知,B发生消去反应生成C为
,结合信息②可知,B发生消去反应生成C为![]() ,C与NBS发生取代反应生成D为
,C与NBS发生取代反应生成D为![]() ,D在氢氧化钠水溶液、加热条件下发生水解反应生成E.
,D在氢氧化钠水溶液、加热条件下发生水解反应生成E.
(1)由上述分析可知,A的结构简式为![]() ,D为
,D为![]() ,D中官能团的名称为:碳碳双键、氯原子;
,D中官能团的名称为:碳碳双键、氯原子;
(2)由上述分析可知,B→C的反应类型为消去反应;
(3)D→E反应的化学方程式为: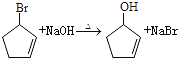 ;
;
(4)M转化为N是醛基转化为羧基,可以检验反应后物质是否含有醛基判断M是否已完全转化为N,实验操作是:取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N,否则M未完全转化为N;
(5)满足下列条件的L(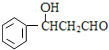 )的同分异构体:①能发生银镜反应,说明含有醛基,②能发生水解反应,含有甲酸形成的酯基,③属于芳香族化合物,含有苯环,含有一个取代基为-CH2CH2OOCH,或者为-CH(CH3)OOCH,含有2个取代基为-CH3、-CH2OOCH,或者为-CH2CH3、-OOCH,各有邻、间、对3种,可以含有3个取代基为2个-CH3、1个-OOCH,2个-CH3有邻、间、对3种,对应的-OOCH分别有2种、3种、1种位置,故符合条件的同分异构体共有14种,其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的结构简式为
)的同分异构体:①能发生银镜反应,说明含有醛基,②能发生水解反应,含有甲酸形成的酯基,③属于芳香族化合物,含有苯环,含有一个取代基为-CH2CH2OOCH,或者为-CH(CH3)OOCH,含有2个取代基为-CH3、-CH2OOCH,或者为-CH2CH3、-OOCH,各有邻、间、对3种,可以含有3个取代基为2个-CH3、1个-OOCH,2个-CH3有邻、间、对3种,对应的-OOCH分别有2种、3种、1种位置,故符合条件的同分异构体共有14种,其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的结构简式为![]() ;
;
(6)参照上述合成路线,设计一条以1-丁醇和NBS为原料制备顺丁橡胶(![]() )的合成路线:CH3CH2CH2CH2OH
)的合成路线:CH3CH2CH2CH2OH![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。有关资料为:
①CuCl为微溶于水的白色固体,在空气中可被迅速氧化
②CuOH为难溶于水的黄色固体,易分解为红色的Cu2O
③Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化为蓝色
I. 甲小组同学用如下装置电解食盐水,并对电解产物进行研究。
实验装置 | 电解质溶液 | 实验现象 | |
| 5mol/L NaCl溶液 | a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U型管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
(1)若a极附近生成的白色浑浊是CuCl,则铜丝a应与电源的________极相连,铜丝a的电极反应式是____。
(2)b极附近溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是_____________(用方程式表示)。
(4)a极附近沉淀自下而上变为橙黄色原因是____________。
II. 乙小组同学通过以下方案制取CuCl并对其组成进行研究。
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸调节到pH=3左右,即可得到白色沉淀CuCl。
(1)写出产生CuCl的离子方程式______________。
(2)为了提高CuCl的产率,可采用________法快速过滤,生产过程中调节溶液的pH不能过大的原因是___。
(3)为探究白色沉淀的化学组成,将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H+ + NO3-=3Fe3++2H2O+NO↑
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 136g熔融的KHSO4中含有2NA个阳离子
B. 40gH218O与40gD2O所含的中子数均为20NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA
D. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL1molL﹣1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com