
【题目】现有浓度均为1 mol/L的FeCl3、CuCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。已知,氧化性Fe3+> Cu2+下列有关叙述正确的是( )
A.反应后的溶液中n(Fe2+)是0.15 molB.反应后的溶液中不存在Fe3+和Cu2+
C.反应后残留固体为3.2 gD.反应后残留固体中可能含有未反应的铁粉
【答案】C
【解析】
n(FeCl3)=cV=1mol/L×0.1L=0.1mol,n(Fe3+)=0.1mol,n(CuCl2)=cV=1mol/L×0.1L=0.1mol, n(Cu2+)=0.1mol,n(Fe)=![]() =0.1mol,根据氧化性Fe3+>Cu2+,铁粉会先和Fe3+反应,若铁粉有剩余,再和Cu2+反应,
=0.1mol,根据氧化性Fe3+>Cu2+,铁粉会先和Fe3+反应,若铁粉有剩余,再和Cu2+反应,
![]()
![]()
A.反应后的溶液中n(Fe2+)是0.15 + 0.05 = 0.2 mol,故A错误;
B.反应后的溶液中不存在Fe3+,但是还剩余0.05 mol Cu2+,故B错误;
C.反应后残留固体为生成的铜单质,其质量为0.05 mol × 64 g/mol = 3.2 g,故C正确;
D.反应后残留固体只有铜单质,铁粉已经反应完全,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
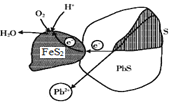
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )
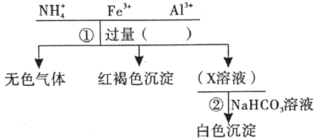
A.步骤①所加试剂可以是浓KOH溶液
B.可以用湿润的蓝色石蕊试纸检验生成的无色气体
C.步骤②的反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.检验Fe3+的离子反应方程式为Fe3++3SCN-=Fe(SCN)3↓(血红色)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图 1,电池的工作原理如下图 2。下列有关说法正确的是

A.放电时,纸张中的石墨作锂电池的正极
B.开关 K 闭合给锂电池充电,金属锂电极上发生氧化反应
C.充电时,空气电极的反应式为: Li2O2 +2e- = 2Li+O2↑
D.电池工作时,电子的流向为:金属锂电极→有机电解质溶液→空气电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备ClNO。查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
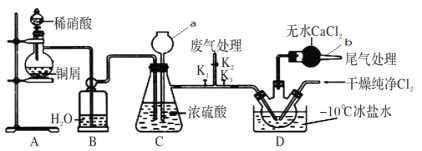
回答下列问题:
(1)仪器a的名称为________,b的作用是________。
(2)ClNO分子中各原子均满足8电子稳定结构,则ClNO的电子式为__________;ClNO与水反应的化学方程式为__________。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中_________________时关闭K1、K2;向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO,D中发生的反应方程式为________。
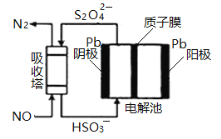
(4)NO可用间接电化学法除去,其原理如下图所示。电解池阴极的电极反应式为________;吸收塔内发生的离子方程式为_______。
(5)亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.87mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。(已知:Ag2CrO4为砖红色固体),则亚硝酰氯(ClNO)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示。下列说法中正确的是
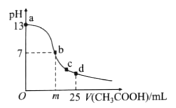
A.在b点的溶液中:m>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.在c点的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在d点的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在a一b的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | H | |||||||
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | S | Cl |
(1)金属性最强的元素是______(填元素符号)。
(2)最不活泼元素的原子结构示意图为________。
(3)第3周期元素中,其最高价氧化物对应得水化物具有两性得元素是______(填元素名称)。
(4)Na、Mg两种元素中,原子半径较大的是______。
(5)第3周期中,某元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为_______。
(6)工业上可以用Cl2和H2来制取盐酸该反应的方程式为_______________________________。
(7)HF与HCl热稳定性较强的是_________。
(8)由碳与氢元素形成的最简单有机物的化学式为_____,该物质中碳元素与氢元素的质量比为_________,其分子空间构型为_____________。
(9)重氢![]() 和超重氢
和超重氢![]() 两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com