
【题目】有关反应“H-+NH3 = H2 +![]() ”的说法正确的是
”的说法正确的是
A. 该反应属于置换反应 B. NH3是氧化剂
C. H-、NH3的总能量与H2、![]() 的总能量之差为该反应的活化能 D. 若反应中有lmol电子转移,则生成1gH2
的总能量之差为该反应的活化能 D. 若反应中有lmol电子转移,则生成1gH2
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 醋酸溶解水垢中的CaCO3:CaCO3+2H+ = Ca2++H2O+CO2↑
B. NaAlO2溶液中通入过量CO2: AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-
C. 用热的NaOH溶液溶解S:3S+4OH-![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D. 稀硫酸与氢氧化钡溶液反应:H+ + OH-+SO42-+ Ba2+= BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
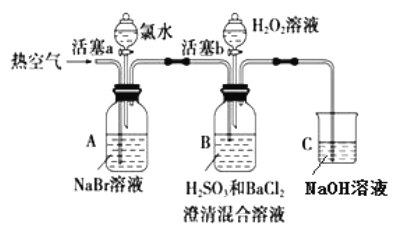
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取l0mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取l0mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验l后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。

回答下列问题:
(1)原溶液中不存在的离子有________,存在的离子有___________________。
(2)实验3中,图像中OA段反应的离子方程式为___________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目___________,该反应的氧化产物是___________。
(2)其中氧化剂与还原剂的物质的量之比是___________;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是___________L。
Ⅱ.盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为________mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、___________、___________。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是____________。
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]()
C. 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)天然气和CO2通入聚焦太阳能反应器,发生反应CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=_______________(用含a、b、c的代数式表示)kJ/mol。
2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=_______________(用含a、b、c的代数式表示)kJ/mol。
(2)CO2和H2可以合成二甲醚(CH3OCH3)。二甲醚是一种绿色环保型能源,以稀硫酸为电解质溶液,若某二甲醚空气燃料电池每消耗l mol CH3OCH3,电路中通过9 mol电子,则该电池效率η为___________。(提示:电池效率等于电路中通过的电子数与电池反应中转移电子总数之比)
(3)325K时,在恒容密闭容器中充入一定量NO2 ,发生反应:2NO2(g)![]() N2 O4(g)。
N2 O4(g)。
①NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为:____________;
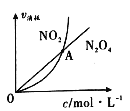
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 能够说明上述反应已经达到平衡状态的有__________________;
a.NO2和N2 O4的物质的量相等 b.体系颜色不再变化
c.容器内混合气体的密度不再改变 d.容器内气体压强不发生变化
③若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_____。
(4)实验中多余的SO2可以用氢氧化钠溶液吸收。常温下H2SO3的Ka1=1.3×10-2、Ka2=6.6×10-8。
①室温下pH=3的亚硫酸溶液,下列判断正确的是_______________。
a.溶液中c(H2SO3)>c(SO32—) b.溶液中c(SO32—):c(HSO3—)=6.6×10-5
c.溶液中氢离子数目为6.02×1020个 d.加入等体积pH=3的硫酸溶液,亚硫酸的电离平衡不移动
②常温下,用含1mol氢氧化钠的稀溶液吸收足量SO2气体,放出热量为QkJ,该反应的热化学方程式为_______
③若吸收液中c(HSO3—)=c(SO32—),则溶液中c(H+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g H2O 所含的中子数为8NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com