
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。其中反应④的离子方程式为 4 NH4++5O2=2 NO2-+6H++N2O+5H2O,下列说法正确的是
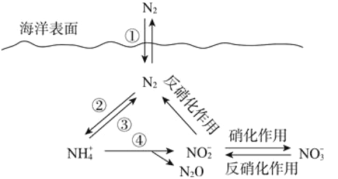
A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定有氧气参加
C. 反应④中每生成 1molH2O 共转移 2mol e-
D. 向海洋排放含NO3- 的废水可能影响海洋中氮的循环
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
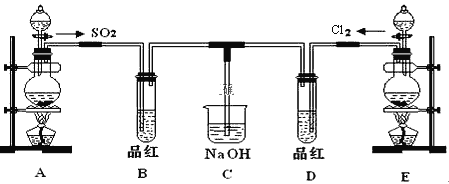
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为_______________________。除去Cl2中混有的HCl,可将气体通过盛有_______________________的洗气瓶。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:_________________________,D:________________________。
(4)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________________,D:__________________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于镁和钠的比较结论正确的是( )
A.都是银白色的金属,在空气中都能稳定存在
B.钠的金属活动性比镁强,所以钠的熔点比镁高
C.都能与稀硫酸发生置换反应,有气体放出
D.在空气中都能燃烧,生成的产物都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: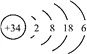 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答下列问题:

(1)元素d在周期表中的位置是_____________,h与f原子序数相差______________
(2)b、c、f的简单离子半径最小的是___________(填离子符号),原子半径最小的是______(填化学式)
(3)表中第三周期元素的非金属性最强是_________(用元素符号表示), e、f、g三种元素的气态氢化物最不稳定的是__________(用化学式表示)
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为________________________
利用元素周期表,我们可以认识更多元素的性质
(5)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别Be(OH)2和Mg(OH)2可选用的试剂为__________溶液
(6)铅(Pb)、锡(Sn)、锗(Ge)与元素(C)、硅(Si)同主族,常温下其单质在空气中,锡、锗不反应而铅表面生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
① 锗的原子序数为__________;
② 铅(Pb)、锡(Sn)、锗(Ge)的+4价氢氧化物的碱性由强到弱的顺序为__________(填化学式)
(7)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来最重大突破。己知铷(Rb)是37号元素,质量数是85,与钠同主族。回答下列问题:
①铷在周期表中的位置为___________________
②同主族元素的同类化合物的性质相似,请写出:
AlCl3与过量的RbOH反应的离子方程式:_____________________________
③现有铷和另一种碱金属形成的混合金属50g,当它与足量水反应时,放出标准状况下的氢气22.4L,这种碱金属可能是__________
A.Li(7) B.Na(23) C.K(40) D.Cs(133)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为 1.16g·cm-3,其中镁离子的质量分数为 4.1%,500mL 该溶液中 Cl-的物质的量浓度约等于( )
A. 4.0mol·L-1B. 2.4mol·L-1C. 2.1mol·L-1D. 1.26mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
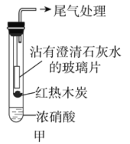
红热木炭未进入试管前,浓硝酸上方并无明显变化。当如图甲连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填选项字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为________。
(2)乙同学设计实验如图乙。
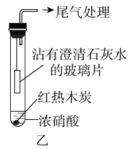
如图乙连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾能将NO、NO2 氧化成 NO3-,MnO4- 被还原为 Mn2+。
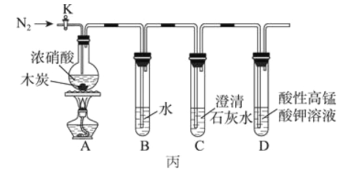
①如图连接装置后,需进行的实验操作为________;加热木炭与浓硝酸前需先通一段时间N2,目的为________________。
②装置A中木炭与浓硝酸反应的化学方程式为_________________________。
③能证明木炭被氧化的实验现象为________________________________________。
④D 装置中发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业生产流程如下:
海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2·6H2O
MgCl2·6H2O![]() MgCl2
MgCl2![]() Mg
Mg
下列说法错误的是( )
A. 此法的优点之一是原料来源丰富
B. 该提取镁的过程中涉及置换、分解、复分解和氧化还原反应
C. 步骤①②③的目的是从海水中提取无水MgCl2
D. 步骤②中加盐酸的离子方程式为Mg(OH)2+2H+Mg2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com