
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����ijһԪ�ء����ݱ�������Ԫ�ػش��������⣺

��1��Ԫ��d�����ڱ��е�λ����_____________��h��fԭ���������______________
��2��b��c��f�ļ����Ӱ뾶��С����___________�����������ţ���ԭ�Ӱ뾶��С����______���ѧʽ��
��3�����е�������Ԫ�صķǽ�������ǿ��_________����Ԫ�ط�����ʾ���� e��f��g����Ԫ�ص���̬�⻯����ȶ�����__________���û�ѧʽ��ʾ��
��4��gԪ����bԪ�ص�����������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽΪ________________________
����Ԫ�����ڱ������ǿ�����ʶ����Ԫ�ص�����
��5��Ԫ�����ڱ�λ�ڶԽ��ߵ�����Ԫ�����������Ƴ�֮Ϊ�Խ��߹��������ڱ��Խ��߹��ɣ�����Be���ʼ��仯����������������ʼ��仯������������ơ������Be(OH)2��Mg(OH)2��ѡ�õ��Լ�Ϊ__________��Һ
��6��Ǧ(Pb)������Sn�����ࣨGe����Ԫ�أ�C)���裨Si��ͬ���壬�������䵥���ڿ����У��������Ӧ��Ǧ��������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ�
�� ���ԭ������Ϊ__________��
�� Ǧ��Pb��������Sn�����ࣨGe����+4����������ļ�����ǿ������˳��Ϊ__________���ѧʽ��
��7��������¹���ѧ��ʵ�����ԭ�����峬����̬���Ե̬�Ŀ���ת�����óɹ��������Ӽ�����о�����������ش�ͻ�ơ���֪﨣�Rb����37��Ԫ�أ���������85������ͬ���塣�ش��������⣺
��������ڱ��е�λ��Ϊ___________________
��ͬ����Ԫ�ص�ͬ�������������ƣ���д����
AlCl3�������RbOH��Ӧ�����ӷ���ʽ��_____________________________
������墨���һ�ּ�����γɵĻ�Ͻ���50g������������ˮ��Ӧʱ���ų���״���µ�����22��4L�����ּ����������__________
A��Li(7) B��Na(23) C��K(40) D��Cs��133��
���𰸡��������ڢ�A�� 18 Mg2+ S Cl PH3 NaOH+HClO4=NaClO4+H2O NaOH 32 Pb(OH)4> Sn(OH)4> Ge(OH)4 �������ڢ�A�� Al3++4OH-= AlO2-+2H2O AB
��������
��Ԫ�������ڱ��е�λ�ÿ�֪��aΪN��bΪNa��CΪMg��dΪAl��eΪP��fΪS��gΪCl��hΪSe��
��1����������=���Ӳ�����������������������������
��2��f��������3�����Ӳ㣬b��c���������������Ӳ��Ҿ�����ͬ�ĵ��Ӳ�ṹ��ԭ�����������Ӱ뾶С��
��3��ͬһ���ڣ��������ң��ǽ���������ǿ��
��4��gԪ����bԪ�ص�����������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽΪ��NaOH+HClO4=NaClO4+H2O.
��5��Be(OH)2����������������ܺ�ǿ�ᷴӦ���ܺ�ǿ�Ӧ��
��6���� ���ԭ������Ϊ32��
��ͬһ����������£�����������ǿ������������ˮ����ļ�������ǿ ��
��7����﨣�Rb����37��Ԫ�أ�������ڱ��е�λ��Ϊ�������ڢ�A�塣
��﨣�Rb����37��Ԫ�أ���������85������ͬ���壬AlCl3�������RbOH��Ӧ�����ӷ���ʽΪ��Al3++4OH-= AlO2-+2H2O��
��墨�ˮ��Ӧ�Ļ�ѧ����ʽΪ2Rb+2H2O=2RbOH+H2�������������ʵ���Ϊ1mol����2M+2H2O=2MOH+ H2����
2 1
2 mol 1mol
�������ƽ��Ħ������Ϊ50g/2 mol=25g/mol��Rb��Ħ������Ϊ85g/mol������һ�������Ħ������һ��С��25g/mol��������һ�����������Li(7) ��Na(23)��
��Ԫ�������ڱ��е�λ�ÿ�֪��aΪN��bΪNa��CΪMg��dΪAl��eΪP��fΪS��gΪCl��hΪSe��
��1����������=���Ӳ�����������������������������Ԫ��d�����ڱ��е�λ���ǵ������ڢ�A�壬h��fԭ���������18 ���ʴ�Ϊ���������ڢ�A�壻18��
��2��f��������3�����Ӳ㣬b��c���������������Ӳ��Ҿ�����ͬ�ĵ��Ӳ�ṹ��ԭ�����������Ӱ뾶С���ʼ����Ӱ뾶��С����Mg2+��ԭ�Ӱ뾶��С����S���ʴ�Ϊ��Mg2+��S��
��3��ͬһ���ڣ��������ң��ǽ���������ǿ���ʵ�������Ԫ�صķǽ�������ǿ��Cl��eΪP��fΪS��gΪCl����̬�⻯����ȶ�����PH3���ʴ�Ϊ��Cl��PH3��
��4��gԪ����bԪ�ص�����������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽΪ��NaOH+HClO4=NaClO4+H2O���ʴ�Ϊ��NaOH+HClO4=NaClO4+H2O��
��5���������⣬����Be���ʼ��仯����������������ʼ��仯������������ƣ�����Be(OH)2����������������ܺ�ǿ�ᷴӦ���ܺ�ǿ�Ӧ������Be(OH)2��Mg(OH)2��ѡ�õ��Լ�ΪNaOH���ʴ�Ϊ��NaOH��
��6���� ���ԭ������Ϊ32���ʴ�Ϊ��32��
��ͬһ����������£�����������ǿ������������ˮ����ļ�������ǿ ����Ǧ��Pb��������Sn�����ࣨGe����+4����������ļ�����ǿ������˳��ΪPb(OH)4> Sn(OH)4> Ge(OH)4���ʴ�Ϊ��Pb(OH)4> Sn(OH)4> Ge(OH)4��
��7����﨣�Rb����37��Ԫ�أ�������ڱ��е�λ��Ϊ�������ڢ�A�壬�ʴ�Ϊ���������ڢ�A�塣
��﨣�Rb����37��Ԫ�أ���������85������ͬ���壬AlCl3�������RbOH��Ӧ�����ӷ���ʽΪ��Al3++4OH-= AlO2-+2H2O���ʴ�Ϊ��Al3++4OH-= AlO2-+2H2O��
��墨�ˮ��Ӧ�Ļ�ѧ����ʽΪ2Rb+2H2O=2RbOH+H2�������������ʵ���Ϊ1mol����2M+2H2O=2MOH+ H2����
2 1
2 mol 1mol
�������ƽ��Ħ������Ϊ50g/2 mol=25g/mol��Rb��Ħ������Ϊ85g/mol������һ�������Ħ������һ��С��25g/mol��������һ�����������Li(7) ��Na(23)���ʴ�Ϊ��AB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S ��SO2 ��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ�����������Щ�к�������ŷš�
I.H2S �ij�ȥ
����1: ������H2S����Ӧ��ԭ��ΪH2S + Fe2(SO4)3==S��+2FeSO4+H2SO4��4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O��
2Fe2(SO4)3 +2H2O��
��1����˾�����ʱ��FeSO4����������������ʱ��5��105 �����þ���������______��
��2����ͼ1��ͼ2 �жϣ�ʹ����˾����������Ϊ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����______________��


����2: ��һ�������£���H2O2 ����H2S
��3�����Ųμӷ�Ӧ��n(H2O2)/n(H2S) �仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ���������� �ķ���ʽΪ________��
II.SO2 �ij�ȥ
����1( ˫�): ��NaOH ����SO2 ������CaO ʹNaOH ����:NaOH ��Һ![]() Na2SO3
Na2SO3
��4��д�������������ӷ���ʽ:_________________��
��5��CaO ��ˮ�д�������ת��:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)����ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��:_______________��
Ca2+(aq) +2OH- (aq)����ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��:_______________��
����2:�ð�ˮ��ȥSO2
��6����֪25����NH3��H2O��Kb=1.8��10-5��H2SO3��Ka1=1.3��10-2��Ka2=6.2��10-8������ˮ��Ũ��Ϊ2.0mol/L����Һ�е�c(OH-)=________����SO2 ͨ��ð�ˮ�У���c(OH-)����1.0��10-7mol/Lʱ����Һ�е�c (SO32-)/c(HSO3-) =_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ���һ�������Դ����,����������Щ��Դ�ǿ�ѧ�о�����Ҫ���⡣��ͼΪ��ˮ��Դ���õIJ��ֹ���,�й�˵����ȷ���ǣ� ��
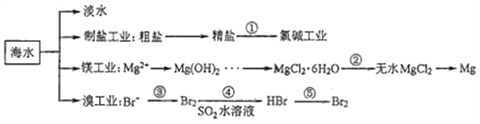
A. ��ˮ�����ķ�����Ҫ����������������������
B. �ȼҵ�в��������ӽ���Ĥ����߲�Ʒ�Ĵ���
C. ��MgCl2��6H2O�õ���ˮMgCl2�Ĺؼ���Ҫ����С����
D. �幤ҵ�Тۡ��ܵ�Ŀ����Ϊ�˸�����Ԫ�أ���Ԫ���ڷ�Ӧ�ۡ����о����������ڷ�Ӧ���б���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�ټ��ء�Ѫ�쵰��Ҷ�����к��е�����Ԫ�������� ( )
A.I��Mg��FeB.I��Fe ��MgC.Cu��Mg��ID.Fe ��Mg��I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ��й���ѧ���з���һ��̼���ε�����������ʵ����ľ����ѡ�������õ���������ش��������⣺
��1����̬̼ԭ�ӵĺ��������____���˶�״̬�� ��̬Niԭ�ӵĺ�������Ų�ʽΪ_________________��
��2��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________________��
��3��ͼ1��ʾ��������̼ԭ�ӵ��ӻ���ʽΪ_________�����ڵĻ�ѧ��������_________(����)��

A.���ۼ� B.���Ӽ� C.��λ�� D.������ E.���
��4��̼��������CO����Ϊ����������������壬CO��N2��Ϊ�ȵ����壬��CO�����ЦҼ���м��ĸ�����Ϊ______������۵�Ϊ170�棬Ԥ������___________���塣
��5��һ�ִ������������ þԪ����ɣ��侧���ṹ��ͼ2��ʾ����þ���Ļ�ѧʽΪ__________���侧���߳�Ϊapm����ʽ���㾧���ܶ�Ϊ___________g/cm3 (���ؼ��������������ӵ��곣����ֵΪNA)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���ں����е�ѭ����������������̬ϵͳ�Ļ����ؼ���������������ѭ�����̿�����ͼ��ʾ�����з�Ӧ�ܵ����ӷ���ʽΪ 4 NH4+��5O2��2 NO2-��6H����N2O��5H2O������˵����ȷ����
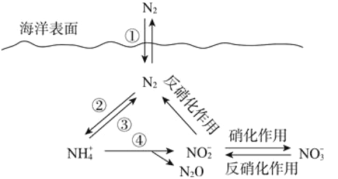
A. �٢ھ����ڹ̵���Ӧ
B. �����еķ���������һ���������μ�
C. ��Ӧ����ÿ���� 1molH2O ��ת�� 2mol e��
D. �����ŷź�NO3- �ķ�ˮ����Ӱ�캣���е���ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�Ƕ���������Ԫ��,��ԭ���������������ڶ�������AԪ��ԭ�Ӱ뾶��С��DԪ��ԭ�Ӱ뾶���B�ļ��⻯���ˮ��Һ�ʼ��ԣ�C��Eͬ����,�γɵĻ�����ΪEC2��EC3���ش���������:
��1��E��Ԫ�����ڱ��е�λ��Ϊ__________��
��2��D2E��Һ�ڿ����г��ڷ��÷�����Ӧ,������֮һΪH��H��Na2O2�Ľṹ�ͻ�ѧ�������ƣ�����Һ�Ի�ɫ��H�ĵ���ʽΪ______��
��3����ѧ�ҷ���һ�ֻ�ѧʽΪA4B4�Ļ�����ɾ���һ����ɵ�������������ɣ��������������Ϊ_______��
��4��B2A4C3��һ�ֳ�����ըҩ�����ڳ�����ײ��ʱ������һ������(B2C)��һ�ֳ���Һ�壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________��8g�����ʷ�Ӧת�Ƶĵ�����ĿΪ________��
��5��������ʵ��˵��Ԫ��F�ķǽ����Ա�Ԫ��E�ķǽ�����ǿ����______��
a.Ԫ��F�γɵĵ��ʱ�Ԫ��E�γɵĵ��ʵ��۵��
b.F��E��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
c.F2ͨ�뵽D2E����Һ�г��ֻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3��һ�ֻ���ԭ�ϣ�����ͨ����Ӧ����һϵ�����ʣ�����ͼ��ʾ��
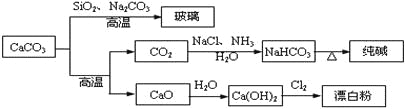
����˵����ȷ���ǣ� ��
A. Cl2��SO2������Ư����ɫ���ʣ���Ư��ԭ����ͬ
B. ��SiO2+ Na2CO3![]() Na2SiO3+ CO2����֪H2CO3������ǿ��H2SiO3
Na2SiO3+ CO2����֪H2CO3������ǿ��H2SiO3
C. ��ҵ�ϣ�������ʳ��ˮ��ͨ��NH3����ͨ��CO2��NaHCO3
D. ��ȡ�����������Ư�����漰�ķ�Ӧ���Ƿ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����
A.Ԫ�����ڱ�����7�����塢7������
B.ϡ������Ԫ��ԭ�ӵ�������������Ϊ8
C.����ԭ�Ӱ뾶��С��Ԫ��
D.��Ԫ��λ�ڵ�3���ڢ�A��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com