
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述反应属于氧化还原反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


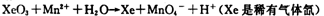


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列说法正确的是
下列说法正确的是| A.Cr2O72-被氧化成CrO5 | B.该反应为氧化还原反应 |
| C.反应中H2O2被还原成H2O | D.此反应用于检验Cr2O72-离子的存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO+NO2+2NaOH==2NaNO3+H2O | B.NH3+HCl== NH4Cl |
| C.Br2+2KI==I2+2KBr | D.2H2O2==2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
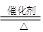 4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,
4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com