
【题目】以铬铁矿为原料![]() 可制备K2Cr2O7和金属铬。实验流程如下:
可制备K2Cr2O7和金属铬。实验流程如下:
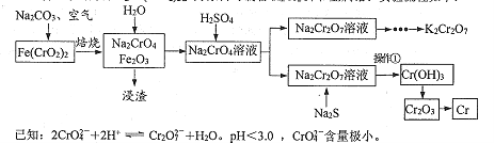
(1)写出铬铁矿焙烧转化为NazCrO4的化学反应方程式:__________________。焙烧时不能使用陶瓷容器的原因是___________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH 应小于3.0,可用 ____测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是_________________。
(4) Na2S的作用是调节溶液的酸碱度和__
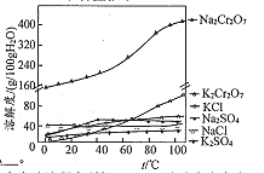
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得NazCrz07溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸、NaOH溶液、KCl固体、蒸馏水):_____。
【答案】 4Fe(CrO2)2+7O2+8Na2CO3 ![]() 2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸没沉淀,待水自然滤出后重复2~3次 将重铬酸钠还原为氢氧化铬 向Na2Cr2O7溶液中加入适量NaOH调节pH大于3.7,过滤,向滤液中加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸没沉淀,待水自然滤出后重复2~3次 将重铬酸钠还原为氢氧化铬 向Na2Cr2O7溶液中加入适量NaOH调节pH大于3.7,过滤,向滤液中加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
【解析】(1)根据流程图可知高温下碳酸钠、氧气与Fe(CrO2)2反应转化为NazCrO4的化学反应方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2。由于陶瓷在高温下会与Na2CO3反应,所以焙烧时不能使用陶瓷容器;(2)要精确测定溶液的pH,应该选择pH计。(3)洗涤沉淀在过滤器中完成,则实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出后重复2~3次;(4)硫离子具有还原性,则Na2S的作用除了调节溶液的酸碱度外,还有将重铬酸钠还原为氢氧化铬的作用;(5)Na2Cr2O7的溶解度大于重铬酸钾,又因为Fe3+在pH为3.7时可完全转化为Fe(OH)3,所以结合已知信息可知由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案为向Na2Cr2O7溶液中加入适量NaOH调节pH大于3.7,过滤,向滤液中加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥即可。
2Fe2O3+8Na2CrO4+8CO2。由于陶瓷在高温下会与Na2CO3反应,所以焙烧时不能使用陶瓷容器;(2)要精确测定溶液的pH,应该选择pH计。(3)洗涤沉淀在过滤器中完成,则实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出后重复2~3次;(4)硫离子具有还原性,则Na2S的作用除了调节溶液的酸碱度外,还有将重铬酸钠还原为氢氧化铬的作用;(5)Na2Cr2O7的溶解度大于重铬酸钾,又因为Fe3+在pH为3.7时可完全转化为Fe(OH)3,所以结合已知信息可知由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案为向Na2Cr2O7溶液中加入适量NaOH调节pH大于3.7,过滤,向滤液中加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥即可。


科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于离子反应的是( )
A. 甲烷与氧气的反应 B. 铝片与稀盐酸的反应
C. 灼热的碳与二氧化碳反应生成一氧化碳 D. 氢氧化钠溶液与稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯(F)是一种具有菠萝香味的赋香剂,其合成路线如下:


已知:(i)
(ii)
(1)A中所含官能团的名称是______________。
(2)M→N的化学方程式____________________________________
(3)N发生银镜反应的方程式_________________________________
(4)M物质环上的一氯代物有__________种
(5)1mol菠萝酯(F)与氢气反应,最多消耗氢气___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+, 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作是___________,(填操作名称)需用到的玻璃仪器除烧杯外还有___________, ___________。
(2)步骤2中发生反应的离子方程式为______________________________
(3)步骤3中发生反应的化学方程式为______________________________
(4)步骤4中涉及的操作是:蒸发浓缩、________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V mLAl2(SO4)3溶液中含有Al3+ a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式______________。
(2)Fe元素位于周期表的________区;Fe与CO易形成配合物Fe(CO)5,原子数目和价电子总数相同的微粒互为等电子体,等电子体具有相似的结构特征,与CO分子互为等电子体的分子和离子分别为________和________(填化学式)。
(3)在CH4和C2H2中,碳原子采取sp3杂化的分子是_________________。
(4)根据VSEPR理论预测ED4-离子的空间构型为________。
(5)B、C、D、E原子相互形成的常见化合物分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为______________________(任写1种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
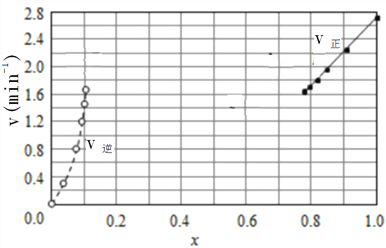
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com