
【题目】V mLAl2(SO4)3溶液中含有Al3+ a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
【答案】C
【解析】
用公式n=![]() 计算VmLAl2(SO4)3溶液中n(Al3+),根据化学式计算VmLAl2(SO4)3溶液中n(SO42-),依据公式c=
计算VmLAl2(SO4)3溶液中n(Al3+),根据化学式计算VmLAl2(SO4)3溶液中n(SO42-),依据公式c=![]() 计算 VmLAl2(SO4)3溶液中c(SO42-);然后根据稀释前后SO42-物质的量不变列式计算稀释后c(SO42-)稀释。
计算 VmLAl2(SO4)3溶液中c(SO42-);然后根据稀释前后SO42-物质的量不变列式计算稀释后c(SO42-)稀释。
VmLAl2(SO4)3溶液中Al3+物质的量n(Al3+)=![]() mol,则VmLAl2(SO4)3溶液中n(SO42-)=
mol,则VmLAl2(SO4)3溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,VmLAl2(SO4)3溶液中c(SO42-)=
mol,VmLAl2(SO4)3溶液中c(SO42-)=![]() mol÷(V×10-3)L=
mol÷(V×10-3)L=![]() mol/L;稀释前后SO42-物质的量不变,则
mol/L;稀释前后SO42-物质的量不变,则![]() mol/L×(
mol/L×(![]() V×10-3)L=c(SO42-)稀释×(4V×10-3)L,解得c(SO42-)稀释=
V×10-3)L=c(SO42-)稀释×(4V×10-3)L,解得c(SO42-)稀释=![]() mol/L,答案选C。
mol/L,答案选C。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数的数值,下列叙述正确的是
A. 标准状况下,22.4LCCl4含有分子数为1 NA
B. 常温常压下,1.42g Na2SO4含的有的Na+离子数为0.01 NA
C. 标准状况下,1.5 NA 个CO2分子占有的体积约为33.6L
D. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,氯水应属于( ) ①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
A.①②④⑥⑦
B.①②⑤⑦
C.②④⑥
D.②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿为原料![]() 可制备K2Cr2O7和金属铬。实验流程如下:
可制备K2Cr2O7和金属铬。实验流程如下:
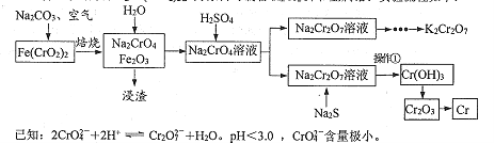
(1)写出铬铁矿焙烧转化为NazCrO4的化学反应方程式:__________________。焙烧时不能使用陶瓷容器的原因是___________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH 应小于3.0,可用 ____测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是_________________。
(4) Na2S的作用是调节溶液的酸碱度和__
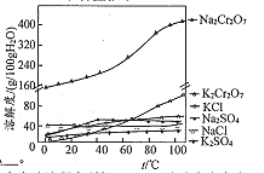
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得NazCrz07溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸、NaOH溶液、KCl固体、蒸馏水):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列既是氧化还原反应,又是吸热反应的是
A.灼热的炭与水蒸气的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀盐酸反应D.甲烷(CH4)在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0 g 14%的NaCl溶液与30.0 g 24%的NaCl溶液混合,混合后得到密度为 1.17 g·cm-3的溶液。请计算:
(1)混合后的溶液中NaCl的质量分数是多少?___________
(2)混合后的溶液的物质的量浓度为多少?_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com