
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
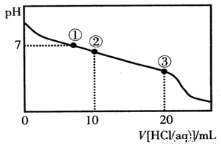
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
C
【解析】
试题分析:A.点①所示溶液中pH=7,则:c(H+)=c(OH-);根据物料守恒可得c(Na+)=c(Cl-)+c(CH3COO-).盐的电离远大于弱电解质水的电离,因此微粒关系是c(Na+)=c(Cl-)+c(CH3COO-)>c(H+)=c(OH-)。错误。B.点②所示溶液中,由于发生反应:CH3COONa+HCl= CH3COOH+NaCl.由于二者是以2:1物质的量关系混合的,所以反应后的溶液为CH3COONa、CH3COOH、NaCl按照1:1:1的物质的量关系混合。由于CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-) >c(CH3COOH), c(CH3COO-) > c(Cl-);根据物料守恒可得c(Na+) >c(CH3COO-)。因此微粒的关系为c(Na+)>c(CH3COO-) >c(Cl-)>c(CH3COOH)。错误。C.点③所示溶液中恰好发生反应CH3COONa+HCl= CH3COOH+NaCl。得到的溶液为CH3COOH和NaCl的混合溶液。由于CH3COOH要发生电离作用,所以c(Na+)>c(CH3COOH);在溶液中除了醋酸电离产生H+外,还存在水的电离平衡,因此c(H+)>c(CH3COO-);但是醋酸是弱酸,电离程度是微弱的,因此c(CH3COOH)>c(H+)。故微粒关系为: c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)。正确。D.根据物料守恒可得: c(Na+)=c(CH3COO-)+c(CH3COOH)。因此比可能出现c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)。错误。
考点:考查混合溶液中微粒的浓度大小比较的知识。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
下列有关有机物的说法正确的是( )
A.甲烷、乙烯和苯在工业上都可通过石油分馏得到。
B.米酒变酸的过程涉及了氧化反应。
C.乙烯和聚丙烯都能与氢气在一定条件下发生加成反应。
D.淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有机物属于烃的是( )。
A.C3H8 B.C2H5OH C.CH2C12 D.
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:简答题
(12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)  2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释MgF2与SiF4熔点差异的原因 。
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
则A的电负性 B的电负性(填“>”、“<”或“=”)。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
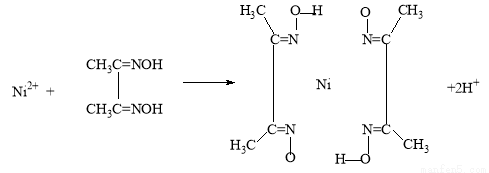
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm ,X、Y、W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,
下列说法正确的是( )
|
|
|
| X |
Y |
|
| W |
|
A.元素Z处于周期表的阴影位置
B.X与W形成的化合物熔点很高,为离子化合物
C.X、W的最高价氧化物对应水化物的酸性: X>W
D.Y、W的最高价氧化物的晶体类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.前四周期中,原子最外层为1个电子的元素有5种
B.Fe2+的价电子排布为3d6
C.2p轨道上有1个未成对电子的原子与3p轨道上有1个未成对电子的原子化学性质相似
D.AB3型分子的中心原子A采取sp3杂化
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是( )
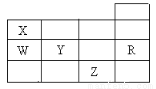
A.常温下,Z单质为气态物质
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性要比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温下,23g NO2含有NA个氧原子
B.1L 0.1mol·L-1的氨水含有0.1NA个OH-
C.常温常压下,22.4LCCl4含有个NA个CCl4分子
D.1molFe2+ 与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com