
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释MgF2与SiF4熔点差异的原因 。
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
则A的电负性 B的电负性(填“>”、“<”或“=”)。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
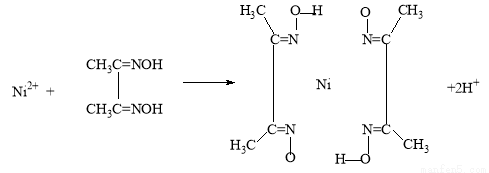
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
(1) Cu2O ;(2)MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体
(3)> ;(4)Fe3O4;(5) 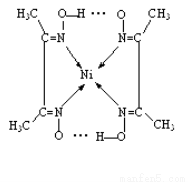
【解析】
试题分析:(1)在该晶体中含有的O的个数是:8×1/8+1=2;含有的Cu的个数是:4×1=4,Cu:O=4:2=2:1,所以化学式为Cu2O;(2)MgF2为离子晶体,离子间通过离子键结合,离子键是一种强烈的相互作用,断裂消耗较高的能量,而SiF4为分子晶体,分子间通过分子间作用力结合。分子间作用力比化学键弱的多,因此离子晶体熔沸点高于分子晶体。(3)A和B为同一周期的元素。由电离能数据可以看出A的核外电子数比B多,所以原子序数A>B。原子序数越大,元素的非金属性就越强,元素的电负性就越大。因此元素的电负性A>B。(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5中V的未成对电子数是0;CrO2中Cr的未成对电子数是2;Fe3O4中Fe的未成对电子数是4、5,比前两种物质都多。因此更适合作录音带磁粉原料的是Fe3O4;(5)在配合物中化学键和氢键表示为: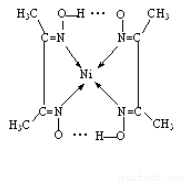 。
。
考点:考查晶体的化学式的确定、不同类型的晶体的熔点的比较、元素的电负性的比较、磁性材料的选择、配位化合物中化学键及氢键的表示的知识。


科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
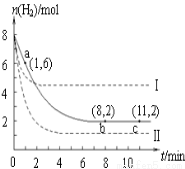
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应?H>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
某有机物4.6克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与8.8克,该有机物可能是( )
A.CH4 B.C2H4 C.C2H6 D.C2H6O
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述错误的是( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
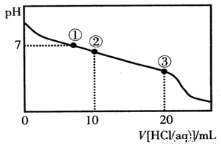
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
下列说法正确的是
A.沸点:H2O>H2S>H2Se>H2Te B.稳定性:SiH4>PH3>H2S >HCl
C.熔点:SiC >KCl> I2>CO2 D.沸点:CH4 >SiH4>GeH4>SnH4
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价 B .单质能与水反应放出氢气
C. 镭比钙的金属性弱 D. 碳酸镭难溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高二下学期期末考试化学试卷(解析版) 题型:简答题
(1)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
①2-甲基丁烷和丁烷 。
②1-已烯和环已烷 。
(2)支链只有一个乙基且式量最小的烷烃的结构简式 。
(3)写出乙醛溶液与足量的银氨溶液共热的化学方程式: ;
(4)写出1,3-丁二烯与溴单质发生1,4-加成的反应方程式
(5)写出由乙醇一步制溴乙烷的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com