
����Ŀ����Ҫ��ش��������⣺
(1)ʵ�����г���NaOH��Һ������ϴ�����ᴿ������100 mL 3 mol/L��NaOH��Һ���ձ�״����4.48 L CO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ________��
(2)��������һ�������0.1 mol/L������Һ�м�ˮϡ�ͺ�����˵����ȷ����________(����ĸ����ͬ)��
A����Һ�е������ӵ���Ŀ��С
B������ĵ���̶�����c(H��)������
C����Һ��![]() ����
����
D������Һ��ϡʱ����Һ��![]() ��С
��С
(3)�������£���V1 mL 0.15 mol/Lϡ������V2 mL 0.1 mol/L NaOH��Һ��ϣ�������Һ��pHΪ1����V1��V2��________(��Һ����仯���Բ���)��
�������£���V1 mL pH��3��HA��Һ��V2 mL pH��11��NaOH��Һ��ϣ�������˵����ȷ����________��
A������Ӧ����Һ�����ԣ���c(H��)��c(OH��)��2��10��7 mol/L
B����V1��V2����Ӧ����ҺpHһ������7
C������Ӧ����Һ�����ԣ���V1һ������V2
D������Ӧ����Һ�ʼ��ԣ���V1һ��С��V2
(4)�����£��������ӿ�ʼ����ʱ��pH�����ʾ��
���� | Fe2�� | Cu2�� | Mg2�� |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ��Cu2����Mg2����Fe2������Һ�еμ�NaOH��Һʱ��________(�����ӷ���)�ȳ�����Ksp[Fe(OH)2]________Ksp[Mg(OH)2](�>������������<��)��
���𰸡�(1)c(Na��)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH��)>c(H��) (2)CD (3)��1��1 ��AD (4)Cu2�� <
)>c(OH��)>c(H��) (2)CD (3)��1��1 ��AD (4)Cu2�� <
��������(1)����Naԭ���غ㣺2n(Na2CO3)��n(NaHCO3)��0.1 L��3 mol/L��0.3 mol������Cԭ���غ㣺n(Na2CO3)��n(NaHCO3)��![]() ��0.2 mol�����n(Na2CO3)��n(NaHCO3)��0.1 mol������CO
��0.2 mol�����n(Na2CO3)��n(NaHCO3)��0.1 mol������CO![]() ��ˮ��̶Ƚϴ���Һ�ʼ��ԣ�������Ũ�ȵĴ�С��ϵΪc(Na��)>c(HCO
��ˮ��̶Ƚϴ���Һ�ʼ��ԣ�������Ũ�ȵĴ�С��ϵΪc(Na��)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH��)>c(H��)��(2)��ˮϡ�ʹٽ�����ĵ��룬��Һ�е������ӵ���Ŀ���࣬A�����������Һ�������ij̶ȱ�H����Ŀ����Ĵ�c(H��)���ͣ�B�����
)>c(OH��)>c(H��)��(2)��ˮϡ�ʹٽ�����ĵ��룬��Һ�е������ӵ���Ŀ���࣬A�����������Һ�������ij̶ȱ�H����Ŀ����Ĵ�c(H��)���ͣ�B�����![]() �з��ӡ���ĸͬ����c(H��)��
�з��ӡ���ĸͬ����c(H��)��![]() ��
��![]() ��һ���¶���Ϊ������C����ȷ��������Һ��ϡ�ͣ�CH3COOH
��һ���¶���Ϊ������C����ȷ��������Һ��ϡ�ͣ�CH3COOH![]() CH3COO����H����ƽ�������ƶ�������Һ��ϡʱ��ˮ�������H�����ɺ��ԣ���
CH3COO����H����ƽ�������ƶ�������Һ��ϡʱ��ˮ�������H�����ɺ��ԣ���![]() ����С��D����ȷ��(3)��������֪
����С��D����ȷ��(3)��������֪![]() ��0.1�����V1��V2��1��1����������������Һ�У�c(OH��)��c(H��)��10��7 mol/L��A����ȷ����V1��V2ʱ����HA��ǿ�ᣬ����Һ��ϳ����ԣ���HAΪ���ᣬ����Һ��ϳ����ԣ�B��C�����D����ȷ��(4)�������ӿ�ʼ����ʱ��pH��֪��Cu2�����ȳ�����Fe2����Mg2������ʱ����Һ��OH����Ũ�ȷֱ�Ϊ10��6.4mol��L��1��10��3.6 mol��L��1������������Ľṹ��������ƣ���Fe(OH)2���ܶȻ���Mg(OH)2��С��
��0.1�����V1��V2��1��1����������������Һ�У�c(OH��)��c(H��)��10��7 mol/L��A����ȷ����V1��V2ʱ����HA��ǿ�ᣬ����Һ��ϳ����ԣ���HAΪ���ᣬ����Һ��ϳ����ԣ�B��C�����D����ȷ��(4)�������ӿ�ʼ����ʱ��pH��֪��Cu2�����ȳ�����Fe2����Mg2������ʱ����Һ��OH����Ũ�ȷֱ�Ϊ10��6.4mol��L��1��10��3.6 mol��L��1������������Ľṹ��������ƣ���Fe(OH)2���ܶȻ���Mg(OH)2��С��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ���������ʺ���������ȥ����A�ǽ������ʣ�D�Ƿǽ������ʣ�B��F��������B��ɫ��ζ��G���������ɫҺ�塣

��ش��������⣺
(1)C�Ļ�ѧʽΪ��______________��
(2)B�ĵ���ʽΪ��______________��
(3)д���۵����ӷ���ʽ��__________________��
(4)д���ڵĻ�ѧ����ʽ�����á������š��������ת�Ƶķ������Ŀ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������������ȷ����(����)
A. 2,3,3���������� B. 2���һ�����
C. 2������3����ϩ D. 3������1,3�����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʳ�ð״����ɴ����봿ˮ���ƶ��ɣ����к͵ζ��ķ���ȷ�ⶨ���д�������ʵ���Ũ�ȡ�ʵ�鲽�裺������500mLŨ��ԼΪ0.1 mol��L��1��NaOH��Һ������KHC8H4O4����Һȷ�ⶨ��NaOH��Һ��Ũ�ȣ�������֪ȷŨ�ȵ�NaOH��Һ�ⶨ�����Ũ�ȡ�
��1�����������NaOH�������ڴ��ձ��У�����500mL����ˮ�������ܽ⡣�����Ʋ��� ����������������������������
��2������ʱNaOH�ڿ����м�����ˮ���������õ�NaOH��ҺŨ��ͨ����Ԥ�� ������С�����������������Dz���ֱ�����������Һ��ԭ��
��3�����İ״װ�װ˵�������Ậ��ԼΪ6g/100mL����������ʵ���Ũ��ԼΪ mol��L��1���ζ�ǰ���״�ϡ�� ������10������100������������֪�������Է�������Ϊ60��
��4��ϡ�Ͱ״�ʱ��Ҫ���������ձ������������ιܡ���ʽ�ζ��ܡ� ��
��5��ȷ��ȡϡ�ͺ�İ״�20.00mL������250mL��ƿ�У���ˮ30mL���ٵμӷ�ָ̪ʾ����������NaOH����Һ�ζ��� ��Ϊ�յ㡣�ظ��ζ����Σ�ƽ������NaOH����ҺV mL��NaOH��ҺŨ��Ϊc mol��L��1����
��6��ԭ�״��д�������ʵ���Ũ�ȣ� mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����У�����ԭ�Ӷ����������Ϊ8���ӽṹ����
A. H3O�� B. BF3 C. CCl4 D. PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ��ۻ������У�Ԫ�ػ��ϼ�����������Ҫԭ���ǣ�������
A.�����е�ʧ
B.���õ��Ӷ���ƫ��
C.���Ӽ��е�ʧ���е��Ӷ�ƫ��
D.�н���Ԫ�صĴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����᳣����������������ͭ�⡢���⡣ijͬѧ���������������еĽ���Ԫ�طֲ������������ϻ�֪������ˮ��Һ�и����ӳ�����pH��Χ��
���� | ��ʼ������pH | ������ȫ��pH |
Fe3�� | 1.0 | 3.0 |
Fe2�� | 5.8 | 8.8 |
Cu2�� | 4.2 | 6.7 |
(1)��������Ũ�Ƚ���1��10��5 mol��L��1Ϊ������ȫ�������ϱ����������Ksp[Fe(OH)3]��________��
(2)�����������ݸ�ͬѧ���������ʵ�����̣�

�Լ�A������________���Լ�B�Ļ�ѧʽ��________________________�������ڵĻ�ѧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2(g) + B2(g)��2AB(g) �������仯��ͼ��ʾ��������������ȷ����( )
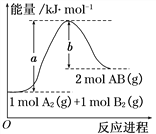
A. ÿ����2mol AB(g) ������b kJ����
B. �÷�Ӧ����H = +(a-b) kJ��mol-1
C. ��Ӧ��������������������������
D. ����1 mol A��A�����ų�a kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. H2(g)��ȼ������H��-285.8 kJ/mol����2H2O(g)��2H2(g)��O2(g) ��H����571.6 kJ/mol
B. ��Ӧ��������������������������ʱ���÷�ӦΪ���ȷ�Ӧ
C. ��ʯī�Ƚ��ʯ�ȶ���֪��c(���ʯ��s)��c(ʯī��s) ��H��0
D. ��֪��298Kʱ��N2(g)��3H2(g) ![]() 2NH3(g) ��H��-92.0 kJ/mol������ͬ�¶��£����ܱ�������ͨ��0.5 mol N2��1.5mol H2���ﵽƽ��ʱ�ų�46.0 kJ������
2NH3(g) ��H��-92.0 kJ/mol������ͬ�¶��£����ܱ�������ͨ��0.5 mol N2��1.5mol H2���ﵽƽ��ʱ�ų�46.0 kJ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com