
 实验室配制480mL 0.1mol?L-1 NaOH溶液,回答下列问题
实验室配制480mL 0.1mol?L-1 NaOH溶液,回答下列问题| n |
| V |
| n |
| V |
 ,故答案为:
,故答案为: .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物的结构简式为 (如图)
某有机物的结构简式为 (如图)查看答案和解析>>
科目:高中化学 来源: 题型:
| A |
| B |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔现象 |
| B、胶体粒子能透过滤纸 |
| C、外观均一、均一、稳定、透明 |
| D、分散质粒子的直径在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2发现电流表指针偏转,下列有关描述正确的是( )
某兴趣设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2发现电流表指针偏转,下列有关描述正确的是( )| A、断开K1,闭合K2时,石墨电极做正极 | ||||
| B、K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- | ||||
| C、断开K2,闭合K1时,石墨电极附近溶液变红 | ||||
D、断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C4H8 |
| B、C8H16 |
C、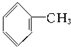 |
D、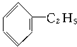 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com