
【题目】中科院长春应化所张新波团队提出了一种独特的锂-氮电池(Li-N2),该电池在放电过程中消耗氮气,充电过程中释放氮气,实现氮气的循环,并对外提供电能。该电池在充电时发生反应:2Li3N![]() N2↑+6Li。现以该电池为电源进行如图所示实验,下列说法正确的是( )
N2↑+6Li。现以该电池为电源进行如图所示实验,下列说法正确的是( )
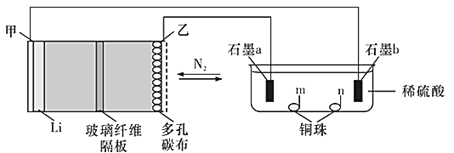
A.乙电极上的反应为2Li3N-6e-=N2↑+6Li+
B.充电过程中Li+由甲电极迁移向乙电极,并在多孔碳布表面生成Li3N
C.电极“石墨a”和m、n处均可能有铜析出
D.锂氮电池为绿色固氮提供了一种可能
【答案】D
【解析】
放电时,该原电池中锂失电子,作负极,发生氧化反应,氮气得电子,作正极,发生还原反应,故甲为负极,石墨b为阴极,乙为正极,石墨a为阳极。
A. 放电时,该原电池中锂失电子作负极,氮气得电子作正极,故乙电极是正极,发生反应:N2↑+6Li++6e=2Li3N,A错误;
B. 充电过程是电解池原理,Li+由乙电极移向甲电极,多孔碳布表面Li3N分解生成N2和Li+,B错误;
C. a是阳极,电解硫酸铜溶液,在阳极:2H2O - 4e- =4H++2O2↑,产生氧气,C错误;
D. 反应:N2+6Li=2Li3N属于氮的固定,锂、氮电池为绿色固氮提供了一种可能,D正确;
答案为D。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S*+e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
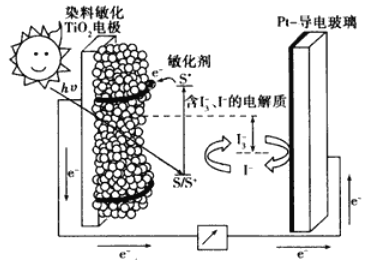
下列关于该电池叙述错误的是
A. 电池工作时,是将太阳能转化为电能
B. 电池工作时,I-离子在镀铂导电玻璃电极上放电
C. 电池中镀铂导电玻璃为正极
D. 电池的电解质溶液中I-和I3-的浓度不会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
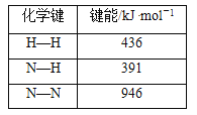
下列说法正确的是( )
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
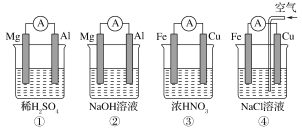
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象结论描述不准确的是( )
A.向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应
B.常温下,向0.10mol·L-1 NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解
C.利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定
D.向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
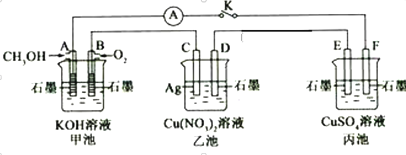
(1)甲池为__________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______________。
(2)丙池中E电极为_________(填“正极”、“负极”、“阴极”或“阳极”),电极的电极反应式为_____________。该池总反应的化学方程式为___________________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是
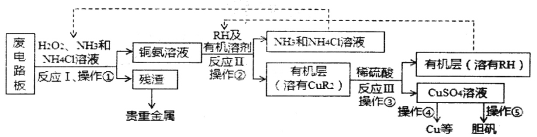
A.反应I的离子方程式为:Cu+H2O+2NH3+2NH4+==Cu(NH3)42++2H2O
B.操作②用到的主要仪器为蒸馏烧瓶
C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4
D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com