


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为 NA |
| C、常温常压下,1 mol氨气含有的原子数为4NA |
| D、1L含1 mol FeCl3溶液中Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
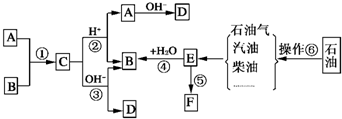 已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.
已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液10mL,测溶液的pH | pH试纸变红(约为4) |
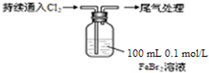 | ⅰ.开始通入100mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | Cl2的氧化性强于Fe3+ | |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
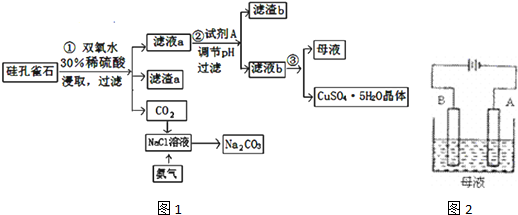
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
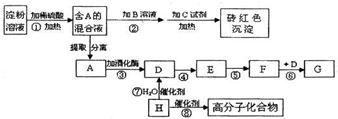
查看答案和解析>>
科目:高中化学 来源: 题型:
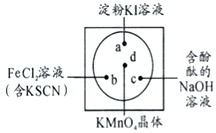 微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.乙炔与与氯化氢反应制取氯乙烯 |
| B、乙烷和氯气反应制取氯乙烷 |
| C、.乙烯与氢气反应制取乙烷 |
| D、.乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu
| |||||
B、Cu
| |||||
C、Cu
| |||||
D、Cu
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com