
| 10 -14 |
| 10 -11 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、0.1 mol H2O中所含的原子总数是0.3NA |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀盐酸、铁和稀醋酸 |
| B、FeCl3和NaOH、FeCl3和NH3?H2O |
| C、BaCl2+H2SO4; Ba(OH)2+Na2SO4 |
| D、NaHCO3+NaOH; NaHSO4+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 |
| B、用平行光照射可以区分FeCl3溶液和Fe(OH)3胶体 |
| C、把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 |
| D、肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
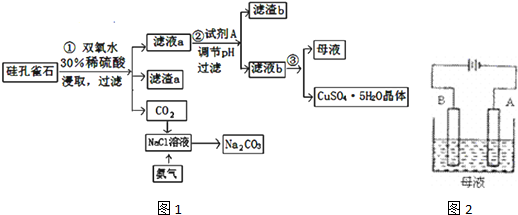
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的摩尔质量是18g |
| B、标准状况下,1.8L CCl4和1.8L NH3所含分子个数相同 |
| C、在标准状况下,1mol任何物质的体积都约为22.4L |
| D、将73gHCl溶于水中配成1L溶液,所得溶液物质的量浓度是2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
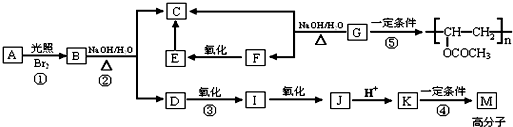
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com