前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是
(填元素符号,下同),电负性最大的是
.
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C
4[D(AB)
6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式
,1mol AB
-中含有π键的数目为
,黄血盐晶体中各种微粒间的作用力不涉及
(填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E
2+的价层电子排布图为
,很多不饱和有机物在E催化下可与H
2发生加成反应:如①CH
2=CH
2、②HC≡CH、③

、④HCHO.其中碳原子采取sp
2杂化的分子有
(填物质序号),HCHO分子的立体结构为
形,它加成产物的熔、沸点比CH
4的熔、沸点高,其主要原因是(须指明加成产物是何物质)
.
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为
.金属C的晶胞中,若设该晶胞的密度为a g/cm
3,阿伏加得罗常数为N
A,C原子的摩尔质量为M,则表示C原子半径的计算式为
.


 、④HCHO.其中碳原子采取sp2杂化的分子有
、④HCHO.其中碳原子采取sp2杂化的分子有
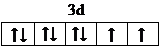 ;
; 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,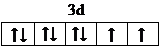 ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;

 小学期末标准试卷系列答案
小学期末标准试卷系列答案 (1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:放电时氧化银电极上的反应式为:
(1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:放电时氧化银电极上的反应式为: )分子中所有碳原子共平面
)分子中所有碳原子共平面 )和东莨菪内酯(
)和东莨菪内酯( )都是某些中草药的成分,它们具有相同的官能团,互为同系物
)都是某些中草药的成分,它们具有相同的官能团,互为同系物 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应
该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应