
【题目】在2A+B![]() 3C十5D反应中,表示该反应速率最快的是
3C十5D反应中,表示该反应速率最快的是
A.v(A)= 0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)= 0.8 mol/(L·s) D.v(D)= 60 mol/(L·min)
【答案】B
【解析】
试题分析:对反应2A+B=3C+5D,都换算成D表示的速率进行比较。A、v(A)=0.5 mol/(Ls),速率之比等于化学计量数之比,故v(D)=![]() v(A)=
v(A)=![]() ×0.5 mol/(Ls)=1.25 mol/(Ls);B、v(B)=0.3mol/(Ls),速率之比等于化学计量数之比,故v(D)=5v(B)=5×0.5 mol/(Ls)=2.5 mol/(Ls);C、v(C)=0.8 mol/(Ls),速率之比等于化学计量数之比,故v(D)=
×0.5 mol/(Ls)=1.25 mol/(Ls);B、v(B)=0.3mol/(Ls),速率之比等于化学计量数之比,故v(D)=5v(B)=5×0.5 mol/(Ls)=2.5 mol/(Ls);C、v(C)=0.8 mol/(Ls),速率之比等于化学计量数之比,故v(D)=![]() v(C)=
v(C)=![]() ×0.8 mol/(Ls)=1.33 mol/(Ls);D、v(D)= 60 mol/(L·min)=1 mol/(Ls),故B表示的反应速率最快,故选B。
×0.8 mol/(Ls)=1.33 mol/(Ls);D、v(D)= 60 mol/(L·min)=1 mol/(Ls),故B表示的反应速率最快,故选B。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= 。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是 、 。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验装置中, A、E分别为NH3和Cl2的发生装置。
请回答下列问题:
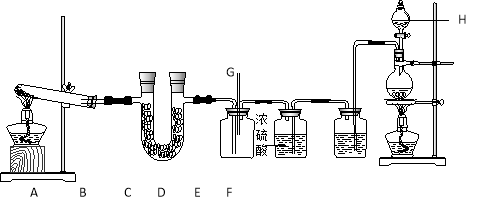
(1)装置E中发生反应的离子方程式为 。
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应。乙:用87g MnO2与足量浓盐酸反应。则所得氯气__________(填字母)。
a.甲比乙多 b.乙比甲多 c.一样多
(3)仪器H的名称是_____________(填名称) ,装置D的作用是 。
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用 进行尾气处理(填选用试剂的名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在①~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),⑤所对应元素的单质工业制备方法为 。
(3)用电子式表示元素③与⑧形成化合物的过程 。
(4)我国首创以单质⑤—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极反应是 ,正极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计如图实验装置(夹持装置略去)制备氯气并探究氯气的相关性质。D装置为分液漏斗形状,低进高出。
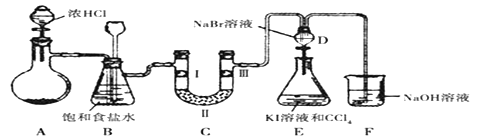
(1)若A装置中固体药品为MnO2,写出其离子反应方程式_________;若A装置中固体药品为KC1O3,则反应中每生成1 mol Cl2时转移电子数目为_______________。
(2)装置B的作用是______和________,若C处发生了堵塞,则B中的现象__________。
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为__________________。
(2)与CO互为等电子体的离子为__________(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4) C60用做比金属及其合金更为有效的新型吸氢材料,其分子结构中每一个C原子皆为SP2杂化,含多个σ键和π键,36gC60最多可以吸收标准状况下的氢气____________L。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是__________________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如下图所示,则其中Ti4+的配位数为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)2Z(g)+W(g)△H<0
达到平衡时,V(A)=1.2aL.试回答:
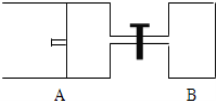
(1)A中X的转化率α(X)= 。
(2)A、B中X转化率的关系:α(A) α(B)(填“>”“=”或“<”)。
(3)平衡时的压强:P(B) 2P(A)(填“>”“=”或“<”)。
(4)打开K,一段时间又达平衡时,A的体积为 L(连通管中气体体积不计)。
(5)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积 (填“变大”“不变”或“变小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com