
【题目】如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)2Z(g)+W(g)△H<0
达到平衡时,V(A)=1.2aL.试回答:
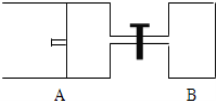
(1)A中X的转化率α(X)= 。
(2)A、B中X转化率的关系:α(A) α(B)(填“>”“=”或“<”)。
(3)平衡时的压强:P(B) 2P(A)(填“>”“=”或“<”)。
(4)打开K,一段时间又达平衡时,A的体积为 L(连通管中气体体积不计)。
(5)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积 (填“变大”“不变”或“变小”)。
【答案】(1)40%;(2)>;(3)>;(4)2.6L ;(5)变小。
【解析】
试题分析:(1) X +Y![]() 2Z+W
2Z+W
起始物质的量 1 1 0 0
变化物质的量 x x 2x x
平衡物质的量(1-x) (1-x) 2x x
A是等压条件下,体积比等于物质的量之比,即a/1.2a=2:(1-x+1-x+2x+x),解得x=0.4,则A的转化率为0.4/1×100%=40%;
(2)B相当于在原来基础上加压,根据勒夏特列原理,增大压强向逆反应方向移动,X的转化率减小,故α(A)>α(B);
(3)假设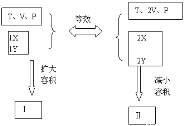 ,
,
等效阶段P′(B)=2P(A),A是恒压状态,B是恒容,需要缩小体积,即增大压强,因此有P(B)>2P(A);
(4)打开K达到平衡时,与A是等效平衡,X的转化率为40%,
X +Y![]() 2Z +W
2Z +W
起始物质的量 3 3 0 0
变化物质的量 1.2 1.2 2.4 1.2
平衡物质的量1.8 1.8 2.4 1.2,
体积比=物质的量之比,2/7.2=a/V,解得V=3.6a,因此A的体积为(3.)6a-a)L=2.6aL;(5)此反应是放热反应,升高温度,平衡向吸热反应方向移动,物质的量减少,体积变小。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C十5D反应中,表示该反应速率最快的是
3C十5D反应中,表示该反应速率最快的是
A.v(A)= 0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)= 0.8 mol/(L·s) D.v(D)= 60 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
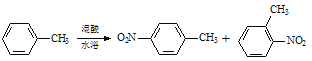
实验中可能用到的数据:
密度/gcm-3 | 沸点/ ℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
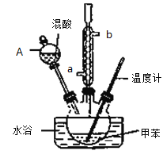
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许 ,目的是 。
(2)冷凝管的作用是 ;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是 ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为 ,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和 、 。
(5)该实验中一硝基甲苯的产率为 (保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,且相对分子质量X>Y,则该反应的化学方程式________,检验Y中阴离子的试剂是__________。
(2)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行。写出A与B反应的离子方程式: ; 。
(3)若A为常见的非金属单质,它是构成有机物的基本元素之一,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,则该反应化学方程式为 。
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出A与B反应生成Y的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.0.1 mol丙烯酸中含有双键的数目为0.1NA
B.标准状况下,11.2 L苯中含有分子的数目为0.5NA
C.1 mol甲苯含有6nA个C—H键
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。I.在具支试管中加入碎瓷片和无水硫酸铝,用注射器吸取一定量石蜡油,重新连接好装置;点燃酒精灯,加热具支试管中的碎瓷片和无水硫酸铝的混合物约两分钟;将注射器中的石蜡油缓慢、逐次推入具支试管中,石蜡油与灼热的碎瓷片和无水硫酸铝接触,将所得气体依次通入酸性高锰酸钾溶液和溴水中,发现酸性高锰酸钾溶液和溴水均褪色.,将导气管迅速替换成燃烧尖嘴,点燃气体,火焰明亮,有黑烟。

(1)碎瓷片和无水硫酸铝的作用是___________。
(2)通过本实验说明____________________。
II.实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100![]() 左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。

(3)A装置中发生反应的离子方程式为 ;
(4)实验时,先点燃A处的酒精灯,当D管处颜色变黄绿色时,再点燃D处的酒精灯,这样操作是为了 。
(5)B装置中应盛放的试剂名称为 ;
(6)F装置所起的作用是阻止空气中的水进入反应器,防止无水三氯化铁潮解和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com