
【题目】向物质的量浓度均为1mol/L的HCl、AlCl3、MgC12、NH4Cl混合溶液中逐滴加入1mol/L的NaOH溶液,得到如图图像。下列有关说法正确的是

A. 沉淀的最大物质的量为2mol
B. c-d段会产生标况下22.4LNH3
C. d-e段发生的反应为Al3++40H-=AlO2-+2H2O
D. 滴加NaOH溶液过程中,微粒反应的先后顺序是H+、Mg2+、NH4+、Al(OH)3
科目:高中化学 来源: 题型:
【题目】HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是( )
A.HgCl2属于离子化合物
B.HgCl2属于共价化合物
C.HgCl2属于非电解质
D.HgCl2是弱酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1∶2
B. 该浓硝酸中HNO3的物质的量浓度是13.0 mol/L
C. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3的热化学方程式为
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
测得CH3OH的物质的量随时间变化如下图所示,回答问题: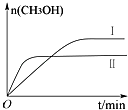
①该反应的平衡常数表达式K=;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠKⅡ(填“>”、“=”或“<”).
③下列措施中能增大CO2转化率的是 . (填序号)
A.升高温度B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入一定量CO2
④下列图象正确且能表明在t时刻反应一定处于平衡状态的是 . (填序号)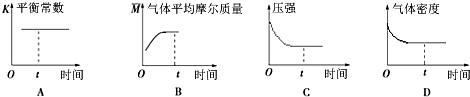
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程从海带中提取碘单质。
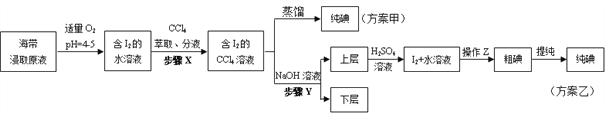
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
C.滴定过程中,锥形瓶中有溶液溅出
D.酸式滴定管未用标准盐酸润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
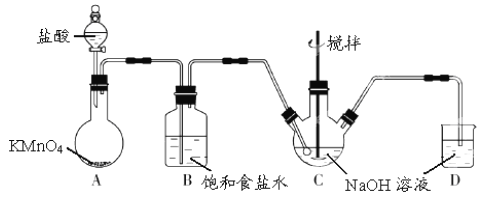
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用是______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3(式量—158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g。
(5)取某 KMnO4(式量-158) 产品 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________(保留三位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com