
����Ŀ�����仯������������;��������ʵ������������±���ʾ��
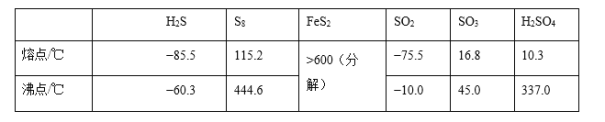
�ش��������⣺
��1����̬Feԭ�Ӽ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ____����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ______�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���_________��
��3��ͼ��a��ΪS8�Ľṹ�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ_____��
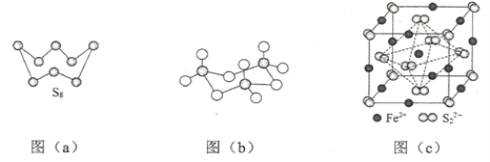
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ_____�Σ����й��ۼ���������_____�֣��������������д�����ͼ��b����ʾ�����۷��ӣ��÷�����Sԭ�ӵ��ӻ��������Ϊ_____��
��5��FeS2����ľ�����ͼ��c����ʾ�������߳�Ϊa nm��FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____g��cm3��������Fe2+λ��S22-���γɵ�������������ģ�����������ı߳�Ϊ____nm��1molFeS2�����к���������������Ϊ____
���𰸡�![]() ���� H2S S8���ڷ��Ӿ��壬�۵�ߵ�������Է��������Ĵ�Сֱ����أ���ΪS8����Է���������SO2��Ķ࣬������۷е��SO2������ ƽ�������� 2 sp3�ӻ�
���� H2S S8���ڷ��Ӿ��壬�۵�ߵ�������Է��������Ĵ�Сֱ����أ���ΪS8����Է���������SO2��Ķ࣬������۷е��SO2������ ƽ�������� 2 sp3�ӻ� 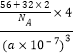 gcm-3
gcm-3 ![]() 2NA
2NA
��������
(1)��̬Feԭ�Ӽ۲����Ϊ��3d��4s�ܼ��ϵ��ӣ���̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
(2)H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3��
=3��
(3)S8��SO2�����Ӿ��壬���Ӿ����۷е�������Ӽ������������ȣ����Ӽ�������������Է������������ȣ�
(4)SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹�ͣ��÷�����S-Oԭ��֮����ڹ��ۼ����÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����ͣ�
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹�ͣ��÷�����S-Oԭ��֮����ڹ��ۼ����÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����ͣ�
(5)�����߳�Ϊanm=a��10-7cm���������=(a��10-7cm)3���þ�����Fe2+����=1+12��![]() =4��S22-����=8��
=4��S22-����=8��![]() +6��
+6��![]() =4���侧���ܶ�=
=4���侧���ܶ�=![]() ��������Fe2+λ��S22-���γɵİ���������ģ�����������ı߳����������ζԽ��ߵij��ȼ��㡣
��������Fe2+λ��S22-���γɵİ���������ģ�����������ı߳����������ζԽ��ߵij��ȼ��㡣
(1)��̬Feԭ�ӵĺ���۵����Ų�ʽΪ[Ar]3d64s2����̬Feԭ�Ӽ۲����Ϊ��3d��4s�ܼ��ϵ��ӣ����̬Feԭ�ӵĺ���۵����Ų�ͼΪ![]() ����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
(2)H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
=3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
(3)S8��SO2�����Ӿ��壬���Ӿ����۷е�������Ӽ������������ȣ����Ӽ�������������Է������������ȣ�S8��Է�����������SO2�����Է��Ӽ�������S8����SO2�������۷е�S8����SO2��
(4)SO3��span>Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����S-Oԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����S-Oԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
(5)�����߳�Ϊanm=a��10-7cm���������=(a��10-7cm)3���þ�����Fe2+����=1+12��![]() =4��S22-����=8��
=4��S22-����=8��![]() +6��
+6��![]() =4���侧���ܶ�=
=4���侧���ܶ�=![]() =
=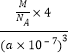 g/cm3=
g/cm3=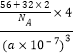 g/cm3��������Fe2+λ��S22-���γɵİ���������ģ������������ƽ��Խ���Ϊ
g/cm3��������Fe2+λ��S22-���γɵİ���������ģ������������ƽ��Խ���Ϊ![]() anm������������ı߳�Ϊ
anm������������ı߳�Ϊ![]() nm��1molFeS2�����к���Fe2+��S22-������Ϊ2NA��
nm��1molFeS2�����к���Fe2+��S22-������Ϊ2NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ���������λΪ����ӵ�ط�չ������Ҫ���Ŀ�ѧ�ҡ�һ������ӵ�س��ʱ��������ӦʽΪ��LiFePO4-xe-=xFePO4+(1-x)LiFePO4+xLi+���ŵ�ʱ�Ĺ���ԭ����ͼ��������������ȷ����
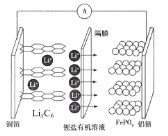
A.�õ�ع���ʱFe��PԪ�ػ��ϼ۾�����
B.�ŵ�ʱ��������ͭ�������·��������
C.���ʱ�������缫Ӧ�ýӵ�Դ������
D.���ʱ��Li+ͨ����Ĥ����ͭ���缫����Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ò��������Ӧʵ����ǣ� ��

A. ��װ�����������������Ļ�ѧ��Ӧ����
B. ��װ�����Ƚ�NaHCO3��Na2CO3�����ȶ���
C. װ�����з�Һ©���ڵ�Һ���˳������������ƿ
D. װ������ʵ����ȡCO2ʵ���е������ؼ�ֹ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2(g)��O2(g)��Ӧ����NO(g)�����е������仯������˵������ȷ����
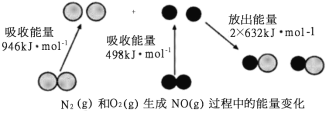
A. 1mol N2(g)��1mol O2(g)��ȫ��Ӧ�ų�������Ϊ180kJ
B. ͨ������£�N2(g)��O2(g)�����ֱ������NO
C. 1mol N2(g)��1mol O2(g)�����������2mol NO(g)���������
D. NO��һ�ֺ���ɫ�����壬����ˮ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѧ����������װ��ͼ�ɹ���ʵ����CO2��H2O�ϳ�CH4�����������������( )

A.��ع���ʱ��ʵ���˽�̫����ת��Ϊ����
B.����� H+ �����ӽ���Ĥ���������ƶ�
C.ͭ�缫Ϊ�������缫��ӦʽΪCO2+8H+-8e-=CH4+2H2O
D.Ϊ��߸��˹����ϵͳ�Ĺ���Ч�ʣ�����װ���м�������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4������Fe��Al������� Ϊԭ���Ʊ�Mg CO3��3H2O��ʵ��������£�

��1�����ܹ�������Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
MgCO3��s��+2H+��aq��=Mg2+��aq��+CO2��g��+H2O H = -50.4kJ��mol-1
Mg2SiO4��s�� +4 H+��aq��=2 Mg2+��aq�� +H2SiO3��s�� + H2O��l�� H =-225.4kJ����mol-1
��Mg2SiO4����Һ��ͨ��CO2����H2SiO3���Ȼ�ѧ����ʽΪ__________���÷�Ӧ��������е�����ѧԭ����_________���÷�Ӧ��ƽ�ⳣ������ʽΪ__________��
��2�������������Һ��������ȡ���������������C16H35O4P����ú����Һ��������pHΪ1.4~4.3����ȡ�������ԼΪˮ��Һ��0.5�����������ֹ���ֲ㣨�ϲ�Ϊ�����������л��㣩����Һ�����Һ�õ����л�������ᷴ��ȡ�õ���������Һ���Ӷ����л�����롣��ȡ��ӦΪ��Fe2��SO4��3��ˮ�㣩+6HA���л��㣩=2FeA3���л��㣩+3H2SO4��ˮ�㣩
�������ȡЧ�ʵĴ�ʩ��__________��
A �ʵ������ȡ����Ũ�� B �ʵ������Һ���
C ����������ȡ D ���ϵش��²��ų����л���
���ڷ���ȡ�м������������___________��
��3����ȡ���ˮ��Һ�Ʊ�Mg CO3��3H2O��ʵ�鷽�����μӰ�ˮ������Һ��pH��һ����Χ�ڣ����ˡ�����Һ�еμ�Na2 CO3��Һ�����衢���á����ˣ���ˮϴ�ӹ���2~3�Σ���50���¸���õ�Mg CO3��3H2O��[��֪����Һ��pH=8.5ʱMg��OH��2��ʼ������pH=5.0ʱAl��OH��3������ȫ]��
�ٵ�����ҺpH�ķ�Χ____________��
���ж�����Һ�еμ�Na2CO3��Һ�����ķ���__________��
��4���ӷ����Ʊ�Mg CO3��3H2O������ʵ�鷽����������ʱ����H2SO4���˹���̫���ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Դ���ճ�����߿Ƽ������ж��й㷺Ӧ�á�����˵������ȷ����

A.ͼ1��пͭԭ����У�Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ�ȼ�С
B.ͼ2��Ŧ��ʽ��п����У������ĵ缫��ӦʽΪAg2O+2e-+H2O+2H+=2Ag+2H2O
C.ͼ3��п�̸ɵ���У�пͲ������������������Ӧ��пͲ��䱡
D.ͼ4��Ǧ����ʹ��һ��ʱ��������Һ�����Լ��������������½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼ��ʾ��װ����ȡ��������������˵��������ȷ����( )

A.��ʱ����������������ƽ�����������������ķ����ƶ�
B.���Թ�a���ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
C.�Թ�b�е������¶˲��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
D.��Ӧ�������÷�Һ�ķ��������Թ�b�еĻ��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com