
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
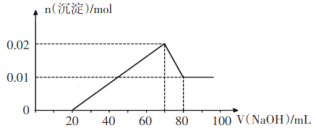
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
【答案】C
【解析】
根据无色溶液,则肯定没有Fe3+;根据②滴加一定浓度的NaOH溶液的图示,得到0~20ml没有沉淀生成,为NaOH与H+反应,则肯定有H+,沉淀生成后立即减少,说明溶液中无![]() ,70~80ml沉淀溶解为Al(OH)3+OH-=AlO
,70~80ml沉淀溶解为Al(OH)3+OH-=AlO![]() +2H2O,且Al(OH)3为0.01mol,说明10mlNaOH溶液含有0.01molNaOH,溶液中有Al3+为0.01mol,则还有0.01mol沉淀为Mg(OH)2,得到溶液中有Mg2+为0.01mol,则溶液中无
+2H2O,且Al(OH)3为0.01mol,说明10mlNaOH溶液含有0.01molNaOH,溶液中有Al3+为0.01mol,则还有0.01mol沉淀为Mg(OH)2,得到溶液中有Mg2+为0.01mol,则溶液中无![]() ,根据NaOH溶液体积关系可知含H+为0.02mol;根据①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03mol,则沉淀为硫酸钡,则
,根据NaOH溶液体积关系可知含H+为0.02mol;根据①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03mol,则沉淀为硫酸钡,则![]() 为0.03mol,由于加入的为BaCl2溶液,所以滴加AgNO3溶液有白色沉淀生成,不能确定原溶液是否含有Cl-;③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色,溶液中还含有
为0.03mol,由于加入的为BaCl2溶液,所以滴加AgNO3溶液有白色沉淀生成,不能确定原溶液是否含有Cl-;③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色,溶液中还含有![]() ,铜与H+和
,铜与H+和![]() 反应生成无色的一氧化氮气体,遇氧气后形成红棕色的二氧化氮。阴离子浓度相同,则NO3-的物质的量也为0.03mol,则阴离子所带负电荷的物质的量=0.03mol×2+0.03mol×1=0.09mol;现确定的阳离子所带正电荷的物质的量=0.01mol×3+0.01mol×2+0.02mol=0.07mol,可知一定含有根据电荷守恒,一定含有K+。
反应生成无色的一氧化氮气体,遇氧气后形成红棕色的二氧化氮。阴离子浓度相同,则NO3-的物质的量也为0.03mol,则阴离子所带负电荷的物质的量=0.03mol×2+0.03mol×1=0.09mol;现确定的阳离子所带正电荷的物质的量=0.01mol×3+0.01mol×2+0.02mol=0.07mol,可知一定含有根据电荷守恒,一定含有K+。
A.根据分析可知,该溶液中一定存在H+、Mg2+、Al3+、![]() 、
、![]() 、K+,可能存在Cl-,A错误;
、K+,可能存在Cl-,A错误;
B..由于无法得到Cl-的浓度,所以c(K+)也无法计算,B错误;
C.根据分析10mlNaOH溶液含有0.01molNaOH,NaOH溶液浓度为![]() =1mol/L,C正确;
=1mol/L,C正确;
D.溶液中含有NO3-的物质的量为0.03mol,H+的物质的量为0.02mol,根据离子方程式3Cu2++8H++2NO3-=3Cu2++2NO↑+4H2O,H+不足,根据H+的量计算铜的质量,则试管3中溶解的铜粉质量![]() ,D错误;
,D错误;
答案选C。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球土壤中含有H、Ne、Na、Mg、Si、S、Cl、Cu等多种元素,是人类未来的资源宝库,回答下列问题:
(1)在下列电子构型中,属于Na原子的激发态构型的是______
A.1s22s22p63s1 B.1s2s22p63p1
C.1s22s22p63s13p1 D.1s22s22p43s3
(2)基态Na、Na+、O、Ne电离最外层一个电子所需能量从小到大的顺序为_________
(3)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,其电离方程式为I2C16![]() ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
(4)在[ Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH______,(填“大”“小”或“相等"),原因是_______
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的O2-组成的多面体的形状为_____,MgO的熔点高于Na2O的原因是_________
(6)硅的晶体结构属于金刚石型,晶胞如图所示。已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的值,则晶胞参数a=_____nm,晶体中Si—Si 键的键长为_______ nm(用含 p、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,交换膜分别是只允许阴阳离子通过的阴阳离子交换膜)。下列叙述中错误的是
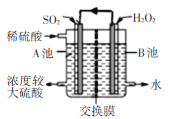
A.该交换膜为阳离子交换膜
B.若11.2 L(标准状况)SO2参与反应,则A池中增加2 mol H+
C.B池中的反应为H2O2+2e-+2H+=2H2O
D.导线上箭头方向表示电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____
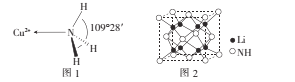
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
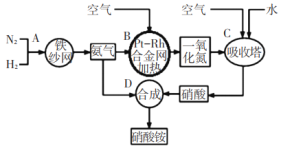
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
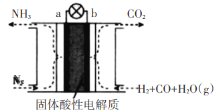
该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态P原子的核外电子排布式为____,有____个未成对电子。
(2)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CC14、SF6互为等电子体,则A为____,其中心原子杂化轨道类型为____,B为____。
(3)PO43-的空间构型为____,其等电子体有____(请写出一种)。
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
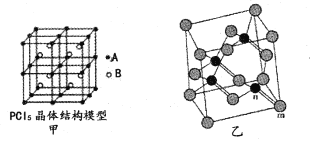
①砷化镓的化学式为____,镓原子的配位数为____。
②砷化镓的晶胞密度=____g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为____pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质 A 是 B(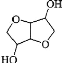 )的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
)的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
A.8B.9C.10D.11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
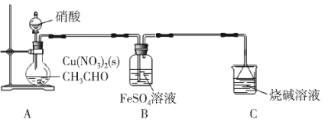
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
(4)分离提纯产品,宜选择下列装置___________(填字母)。
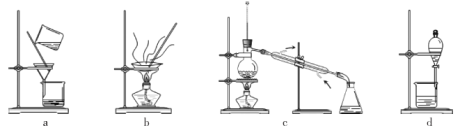
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com