
【题目】月球土壤中含有H、Ne、Na、Mg、Si、S、Cl、Cu等多种元素,是人类未来的资源宝库,回答下列问题:
(1)在下列电子构型中,属于Na原子的激发态构型的是______
A.1s22s22p63s1 B.1s2s22p63p1
C.1s22s22p63s13p1 D.1s22s22p43s3
(2)基态Na、Na+、O、Ne电离最外层一个电子所需能量从小到大的顺序为_________
(3)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,其电离方程式为I2C16![]() ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
(4)在[ Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH______,(填“大”“小”或“相等"),原因是_______
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的O2-组成的多面体的形状为_____,MgO的熔点高于Na2O的原因是_________
(6)硅的晶体结构属于金刚石型,晶胞如图所示。已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的值,则晶胞参数a=_____nm,晶体中Si—Si 键的键长为_______ nm(用含 p、NA的代数式表示)。

【答案】B Na<O<Ne<Na+ V形(角形、折线形) sp3 大 氨分子与Cu2+形成配合物后,孤对电子与Cu2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故H-N-H键角变大 八面体(或正八面体) MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O 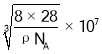
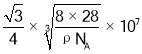
【解析】
(1)A. 1s22s22p63s1是Na原子的基态;B.1s2s22p63p1是Na原子的激发态;C.1s22s22p63s13p1不是Na原子的电子排布式;D.1s22s22p43s3中3s轨道最多只能排布2个电子。
(2)基态Na易失去1个电子,因为核外电子数相同,而Na+的质子数比Ne的质子数多1,对核外电子的控制能力更强,所以Na+的失去最外层一个电子比Ne的失去最外层一个电子大,O、Ne,同周期从左到右失去电子越来越难。
(3)ICl2+离子价层电子对数为![]() 。
。
(4)氨分子与Cu2+形成配合物后,孤对电子与Cu2+成配位键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱。
(5)MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大。
(6)先计算晶胞中Si原子个数,根据密度公式计算得到晶胞参数,晶体中Si—Si键的键长为体对角线的四分之一。
(1)A. 1s22s22p63s1是Na原子的基态,故A不符合题意;B.1s2s22p63p1是Na原子的激发态,故B符合题意;C.1s22s22p63s13p1不是Na原子的电子排布式,故C不符合题意;D.1s22s22p43s3中3s轨道最多只能排布2个电子,故D不符合题意;综上所述,答案为B。
(2)基态Na易失去1个电子,因为核外电子数相同,而Na+的质子数比Ne的质子数多1,对核外电子的控制能力更强,所以Na+的失去最外层一个电子比Ne的失去最外层一个电子大,O、Ne,同周期从左到右失去电子越来越难,因此电离最外层一个电子所需能量从小到大的顺序为Na<O<Ne<Na+;故答案为:Na<O<Ne<Na+。
(3)ICl2+离子价层电子对数为![]() ,立体构型为“V”形,因此中心原子的杂化类型是sp3;故答案为:V形(角形、折线形);sp3。
,立体构型为“V”形,因此中心原子的杂化类型是sp3;故答案为:V形(角形、折线形);sp3。
(4)在[Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH大,原因是氨分子与Cu2+形成配合物后,孤对电子与Cu2+成配位键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故∠HNH键角变大;故答案为:大;氨分子与Cu2+形成配合物后,孤对电子与Cu2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故H—N—H键角变大。
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的6个O2组成的多面体的形状为正八面体,MgO的熔点高于Na2O的原因是MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O;故答案为:八面体(或正八面体);MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O。
(6)硅的晶体结构属于金刚石型,已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的,晶胞中Si原子个数为![]() ,则
,则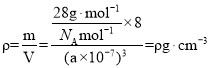 ,晶胞参数a=
,晶胞参数a=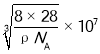 nm,晶体中Si—Si键的键长为体对角线的四分之一,因此晶体中Si—Si键的键长
nm,晶体中Si—Si键的键长为体对角线的四分之一,因此晶体中Si—Si键的键长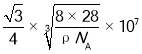 nm;故答案为:
nm;故答案为: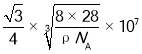 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】有机物的结构简式可以用“键线式”表示,其中线表示键,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。已知利用某些有机物之间的转化可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为 (反应吸热),下列叙述中错误的是( )
(反应吸热),下列叙述中错误的是( )
A. NBD和Q互为同分异构体
B. Q可使溴水褪色
C. Q的一氯代物只有3种
D. NBD的同分异构体可以是芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究化学能与电能的转化,设计下图装置。下列叙述错误的是

A.a和b不连接时,铁片上会有气泡产生
B.无论a和b是否连接,铁片均发生氧化反应
C.a和b用导线连接时,溶液中H+向铁片移动
D.a和b用导线连接时,铜片上发生的反应为2H++2e-== H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-
C. c点,两溶液中含有相同浓度的OH-
D. a、d两点对应的溶液均显中性-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间硝基苯胺是一种重要的有机合成中间体,它是一种黄色针状晶体,微溶于冷水,在水中的溶解度随温度升高而增大,易溶于乙醇、乙醚、甲醇等。实验室制备间硝基苯胺的反应原理及装置如下(夹持及加热装置略去):
4 +6NaHS+H2O→4
+6NaHS+H2O→4 +3Na2S2O3
+3Na2S2O3

实验步骤:
①硫氢化钠溶液的制备。将0.05molNa2S9H2O溶于25mL水中,分批加入4.2gNaHCO3粉末,完全溶解后,慢慢加入30ml.甲醇,冰水浴冷却,立即析出一水合碳酸钠。静置,抽滤,滤饼用15mL甲醇分三次洗涤,合并滤液和洗涤液备用。
②间硝基苯胺的制备。在A中将0.03 mol间二硝基苯溶于40 mL热甲醇中,装上B,从B的顶端加入上述硫氢化钠溶液,水浴加热回流20min。冷却至室温后,改为蒸馏装置,蒸出大部分甲醇,将残液倾入150mL冷水中,立即析出间硝基苯胺粗品,抽滤,洗涤,重结晶,脱色后,得黄色的间硝基苯胺针状晶体2.4 g。回答下列问题:
(1)仪器B的名称是________, 使用时要从_____(填“ a”或“b”)口通入冷水;滴液漏斗的细支管c的作用是________。
(2)写出步骤①中总反应的离子方程式:____________。
(3)步骤①中合并洗涤液的目的是________。
(4)步骤②中制备装置改为蒸馏装置,需增加的仪器除了蒸馏头、温度计、尾接管之外,还有________、________。
(5)步骤②中蒸出大部分甲醇的目的是__________。
(6)步骤②中洗涤粗品使用的洗涤剂为_____;粗品脱色使用的脱色剂可以是______。
(7)本实验的产率为______[保留 2位有效数字;Mr(间硝基苯胺) = 138]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和![]() 数目之和为0.3NA
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积固定的密闭容器中,发生反应H2(g)+I2(g)![]() 2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
A.断裂1 mol H-H键,同时生成2 mol H-I键B.容器内压强保持不变
C.容器内气体颜色保持不变D.容器内H2、I2和HI的物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
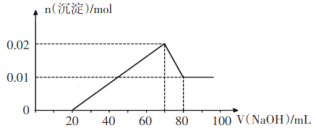
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将SO2通入2L0.01mol·L-1的某一元碱MOH溶液中,溶液中水电离出的OH-的浓度(c)与通入的SO2的体积(V)关系如图所示(不考虑+4价的S被氧化),下列叙述不正确的是
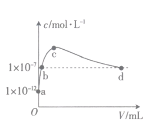
A.MOH为一元强碱
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(M+)=2[c(SO32-))+c(HSO3-)+c(H2SO3)]
D.d点溶液中:c(M+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com