
【题目】如图所示是工业生产硝酸铵的流程。
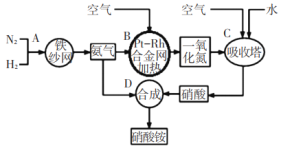
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
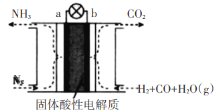
该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
【答案】N2+3H2![]() 2NH3 60% 4NH3+5O2
2NH3 60% 4NH3+5O2![]() 4NO+6H2O 64 b N2+6H++6e-=2NH3
4NO+6H2O 64 b N2+6H++6e-=2NH3
【解析】
从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3,然后NH3和HNO3反应生成NH4NO3,
(2) 在一定温度和压强下,气体的体积比等于物质的量之比,假设通入N2的物质的量为1mol,设H2的转化率为x,列出三段式,可算出H2的转化率;
(4)由H2的质量算出转成氨气的质量,氨气催化氧化制硝酸来计算硝酸质量,再依据氨与硝酸按1:1生成硝酸铵,列等式算得硝酸铵的质量;
(5)原电池中负极失电子发生氧化反应,正极得电子发生还原反应。
(1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2![]() 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2![]() 2NH3;
2NH3;
(2)在一定温度和压强下,气体的体积比等于物质的量之比,则H2和N2的物质的量之比为3:1,假设通入N2的物质的量为1mol,设H2的转化率为x,列出三段式: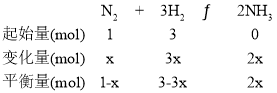 ,
,![]() ,解得x=0.6,则H2的转化率为60%,故答案为:60%;
,解得x=0.6,则H2的转化率为60%,故答案为:60%;
(3)B装置中在Pt-Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)N2+3H2![]() 2NH3,H2的转化率为60%,
2NH3,H2的转化率为60%,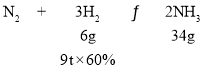 ,9tH2最多可制取氨气的质量为
,9tH2最多可制取氨气的质量为![]() ,设被氧化的氨气为xt,氨气催化氧化制硝酸时损失20%,则生成的硝酸为
,设被氧化的氨气为xt,氨气催化氧化制硝酸时损失20%,则生成的硝酸为![]() ,氨与硝酸按1:1生成硝酸铵,则有
,氨与硝酸按1:1生成硝酸铵,则有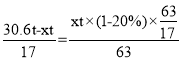 ,解得x=17,所以硝酸铵的质量为
,解得x=17,所以硝酸铵的质量为![]() ,故答案为64;
,故答案为64;
(5)电池工作时,电池b处CO失电子被氧化为生成CO2,故负极为b;a极N2得电子被还原生成NH3,电极反应式为:N2+6H++6e-=2NH3,故答案为:b;N2+6H++6e-=2NH3。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是甲烷、乙烯、丙烯(CH3—CH===CH2)、苯中的一种。
①甲、乙能使溴水褪色,甲分子中所有原子共平面,但乙分子不是所有原子共平面。
②丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色。
③丁既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应。一定条件下,1 mol丁可以和3 mol H2完全加成。
请根据以上叙述完成下列填空:
(1)甲的结构简式是________,官能团的名称是________,丙是________形结构。
(2)甲与溴水发生反应的化学方程式:______________________。反应类型:________甲发生的聚合反应方程式:_________________________
(3)丁与浓硝酸的反应方程式:_________________________。 反应类型 :______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和![]() 数目之和为0.3NA
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
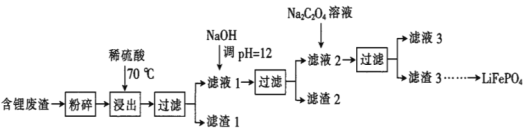
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
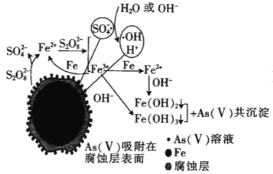
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
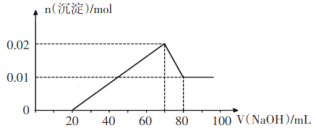
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种化合物结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y是同周期元素,Z的含氧酸均具有氧化性,该化合物相对分子质量小于125。下列有关说法正确的是
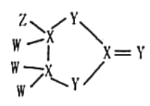
A.WZ沸点高于W2Y的沸点
B.X的含氧酸一定为二元弱酸
C.原子半径大小:Z>Y>X>W
D.X与Z组成的化合物中可能含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 四种物质间的转化关系如图所示 ,下列转化不能一步实现的是( )
序号 | X | Y | Z | W | 转化关系 |
A | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
|
B | Na | NaOH | Na2CO3 | NaCl | |
C | Cl2 | Ca(ClO)2 | HClO | HCl | |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与水蒸气反应,通常有以下两种装置,请思考以下问题:
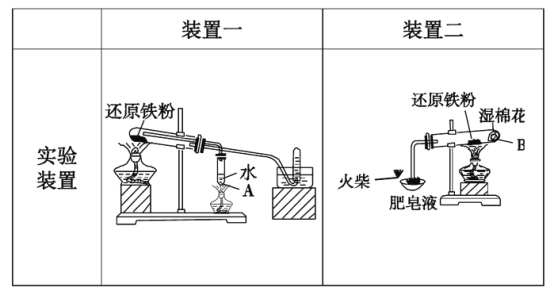
(1)方法一中,装置A的作用________________________。方法二中,装湿棉花的作用_______________________________________。
(2)实验完毕后,取出装置一的少量固体,溶于足量稀盐酸,再滴加KSCN溶液,溶液颜色无明显变化,试解释原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com