
A、c=
| ||||
B、p=m+
| ||||
| C、n=m+17Vc | ||||
D、
|
| ||
| ||
| V |
| Vm |
| n |
| V |
| ||
| ||
| bL |
| 22.4L/mol |
| 1000b |
| 11.2V |
| ||
| ||
| 1 |
| 2 |
| cV |
| 125 |
| 17Vc |
| 1000 |
| m |
| 24 |
| 5m |
| 3 |
| m |
| 27 |
| 1 |
| 2 |
| 17m |
| 9 |


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
| 化学式 | AgCl | AgBr | AgI |
| 颜 色 | 白色 | 浅黄色 | 黄色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
| c(Br-) |
| c(Cl-) |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
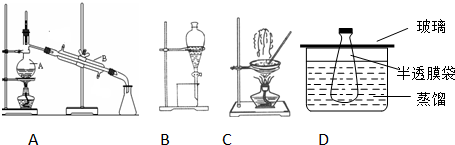
查看答案和解析>>
科目:高中化学 来源: 题型:
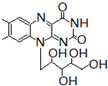 核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知:
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知: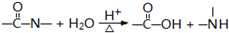
| A、该化合物的分子式为C17H22N4O6 |
| B、酸性条件下加热水解,有CO2生成 |
| C、该分子中有3个手性碳原子(与4个不同基团连接的碳原子叫手性碳原子) |
| D、能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

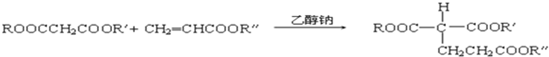 (R、R′、R″代表相同或不相同的烃基).
(R、R′、R″代表相同或不相同的烃基).查看答案和解析>>
科目:高中化学 来源: 题型:
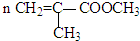
| 催化剂 |
| △ |
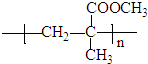
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、K、Cl、S、O |
| B、N、H、O、P、C |
| C、F、I、Fe、Zn、Cu |
| D、Ge、Se、Cu、Mg、C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| B、温度下降10℃,四种溶液的pH均不变 |
| C、分别加水稀释10倍,四种溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
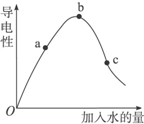 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:| ①H2SO4溶液 HSO4-?H++SO42- | ②NaHSO4溶液 HSO4-?H++SO42- | ③醋酸溶液 CH3COOH?H++CH3COO- | ④盐酸 HCl=H++Cl- |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com