
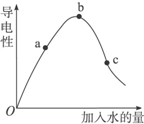
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:| ①H2SO4溶液 HSO4-?H++SO42- | ②NaHSO4溶液 HSO4-?H++SO42- | ③醋酸溶液 CH3COOH?H++CH3COO- | ④盐酸 HCl=H++Cl- |
| 10% | 29% | 1.33% | 100% |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 0.01mol |
| 0.5L |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 0.05×0.05 |
| 0.2-0.05 |


科目:高中化学 来源: 题型:
A、c=
| ||||
B、p=m+
| ||||
| C、n=m+17Vc | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中肯定不存在的离子只有Fe3+ |
| B、Fe3+和Cu2+均能被铁粉还原 |
| C、Fe2+与SCN-能形成红色的物质 |
| D、滤渣中肯定不含有铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③⑤ |
| C、①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、HClO见光会分解,故氯水保存在棕色试剂瓶中 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 a、b曲线分别表示反应CH3CH3(g)→CH2=CH2(g)+H2(g)(△H>0),使用和未使用催化剂时,反应过程中的能量变化 |
B、 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜锌原电池中铜是阳极 |
| B、用电解法精炼粗铜时纯铜作阳极 |
| C、在镀件上电镀铜时可用金属铜作阳极 |
| D、氯碱工业中用铜作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com