
【题目】下图是中学化学中常用于泡合物的分离和提纯装置,请根据装置回答问题:
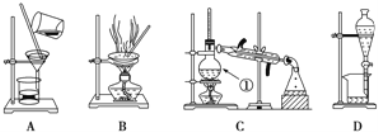
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_____,装置B中玻璃棒的作用是_________。
(2)装置C中①的名称是_____,此装置中冷凝水进出方向是_____。装置D中的分液漏斗在使用之前应该_____,在分液时为使液体顺利滴下,应进行的具体操作是_______。
(3)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的方法是______。加入Na2CO3溶液的目的是_____,所加入的试剂④可以是_____(填化学式)。
(4)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
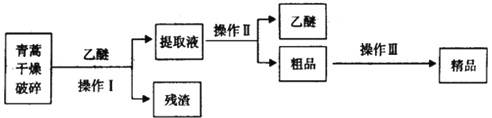
若要在实验室模拟上述工艺,操作I选择的装置是_____(填代号),操作Ⅱ的名称是_____,选择的装置是_____(填代号),为防止暴沸,粗品中需要加入_____。操作Ⅲ的主要过程可能是_____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶、过滤
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
【答案】引流 搅拌防止液体局部受热造成液滴飞溅 蒸馏烧瓶 从下管进上管出 检查是否漏水 打开分液漏斗上方口部的玻璃塞或旋转玻璃塞使凹槽对准小孔 Ba(NO3)2或者是Ba(OH)2 静置,向上层清液中继续滴加Ba(NO3)2或者是Ba(OH)2,若无沉淀产生则已除尽 除去过量的Ba2+ HNO3 A 蒸馏 C 碎瓷片 B
【解析】
(1)A为过滤玻璃棒起引流作用;B为蒸发,玻璃棒起搅拌作用。
(2)装置C中①是蒸馏烧瓶,冷却水从下口进上口出,冷凝效果更好。分液漏斗使用前需检漏,为使液体顺利滴下,应打开上端口部的玻璃塞或旋转玻璃塞使凹槽对准小孔。
(3)某硝酸钠固体中混有少量硫酸钠杂质,可加入硝酸钡或氢氧化钡,将硫酸根转化为硫酸钡沉淀,过滤,向滤液中加入碳酸钠以后,可以将过量的硝酸钡或氢氧化钡转化为碳酸钡沉淀,过滤,再向滤液中加入稀硝酸,将过量的碳酸钠溶液转化为硝酸钠,蒸发结晶后可得纯净的硝酸钠。
(4)青蒿素干燥破碎以后,用乙醚浸取,过滤后得到残渣和提取液,提取液经过蒸馏得到乙醚和粗品,粗品经过溶解、浓缩结晶、过滤得到精品。
(1)在装置A和装置B中都用到玻璃棒,装置A为过滤玻璃棒起引流作用,装置B为蒸发,玻璃棒起搅拌作用防止液体局部受热造成液滴飞溅。
答案为:引流;搅拌防止液体局部受热造成液滴飞溅。
(2)装置C中①名称是是蒸馏烧瓶,装置C中冷却水的方向是下进上出。装置D中的分液漏斗在使用之前应该检漏,分液漏斗为使液体顺利滴下,应打开上端口部的玻璃塞或旋转玻璃塞使凹槽对准小孔。
答案为:蒸馏烧瓶;从下管进上管出;检查是否漏水;打开分液漏斗上方口部的琉璃塞或旋转活塞使凹槽对准小孔。
(3)所加入的试剂①作用是除去硫酸钠,将其转化为硫酸钡沉淀,试剂①可以是Ba(NO3)2或Ba(OH)2。证明溶液中SO42-已经除尽的方法是:静置,向上层清液中继续滴加Ba(NO3)2或Ba(OH)2,若无沉淀产生则已除尽。加入Na2CO3溶液的目的是除去过量的Ba2+,所加入的试剂④可以的目的是除去过量的CO32-,试剂④可以是HNO3。
答案为:Ba(NO3)2或Ba(OH)2;静置,向上层清液中继续滴加Ba(NO3)2或Ba(OH)2,若无沉淀产生则已除尽;除去过量的Ba2+;HNO3。
(4)操作I为过滤,选择装置A。提取液经过蒸馏得到乙醚和粗品,操作Ⅱ为蒸馏,选择装置C,为防止暴沸,需要加入碎瓷片。操作Ⅲ从粗品中经过溶解、浓缩结晶,再进行过滤得到精品。
答案为:A;蒸馏; C; 碎瓷片; B。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.由非金属元素组成的化合物中一定不含离子键
B.离子化合物一定含有金属元素
C.分子中一定含有共价键
D.某种离子化合物可以同时含有离子键、极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是:
A.K2CO3和K2O都属于盐B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】33.6g 含杂质的Na2CO3、NaHCO3均匀混合物平均分成两份,向一份中加入250ml 1.00mol·L-1过量盐酸反应,生成标准状况下3.36L气体。将另一份充分灼烧,干燥后称得固体质量为13.7g。杂质不与酸反应,受热也不分解。求:
(1)原混合物中含有Na2CO3的物质的量。
(2)Na2CO3、NaHCO3的质量比。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求写出方程式:
①HNO3 (电离方程式)_____
②Fe2(SO4)3 (电离方程式)_____
③硫酸钠和氯化钡溶液反应(离子方程式)____
④二氧化碳通入足量氢氧化钠溶液(离子方程式)____________
(2)①0.4molCH4分子中所含原子数与__g HCl分子中所含原子数相等,该HC1气体在标准状况下的体积为________ L;
②等物质的量O2和臭氧(O3),其质量之比为_______;若O2和O3质量相等,则其原子数之比为__。
(3)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥澄清石灰水,其中属于电解质的有_____,属于非电解质的有____(填编号)。
(4)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取: 2Fe (OH) 3 + 4NaOH + 3NaC1O = 2Na2FeO4 + 3NaCl + 5H2O
①该反应中氧化剂是_________(用化学式表示,后同),______元素被氧化,还原物为__________ ;
②用单线桥在方程式中标出电子转移的情况:_______________
③当反应中有lmolNaFeO4生成,转移的电子有_________ mol;
④实验室欲配制250mL0.1 molL-1NaOH溶液,除烧杯、玻璃棒、量筒、胶头滴管,还需要用到的玻璃仪器为__________,下列操作配制的溶液浓度偏低的是__________。
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。

①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。

①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。

(1)D装置中MnO2的作用是_________________。
(2)燃烧管中CuO的作用是_____________________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为__________________。
(4)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为___。
(5)该物质的核磁共振氢谱如图二所示,则其结构简式为_____________。
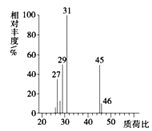
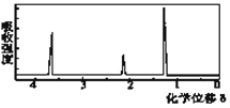
图2 图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)和叠氮酸钠(NaN3)是氮和钠的两种重要化合物。Na3N能与水反应: ![]() 。
。
(1)写出该反应产物中属于离子化合物的电子式:_______________。
(2)写出Na3N与足量盐酸反应的化学方程式:______________________________________。
(3)将该反应中四种元素的简单离子按离子半径由大到小的顺序排列:___________________。
(4)该反应四种元素中的三种,能组成一种在水溶液中显酸性的盐,写出该盐的化学式:______。
(5)O元素的非金属性比N元素强,请用一个事实说明:____________________________。
(6)叠氮酸钠(NaN3)受撞击会分解: ![]() ,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
(7)叠氮酸(HN3)是弱酸,酸性与醋酸相似,写出HN3的电离方程式:___________________;将NaN3水溶液中的离子按浓度由大到小排序:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com