
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
分析 A、氯气和水的反应为可逆反应;
B、20gH218O的物质的量为1mol,且水中含10个质子;
C、求出金刚石的物质的量,然后根据金刚石中含2条共价键来分析;
D、标况下HF为液体.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于1.5NA个,故A错误;
B、20gH218O的物质的量为1mol,且水中含10个质子,故1molH218O中含10NA个质子,故B正确;
C、12g金刚石的物质的量为1mol,而金刚石中含2条共价键,故1mol金刚石中含2NA条共价键,故C正确;
D、标况下HF为液体,标况下33.6LHF的物质的量大于1.5mol,则含有的F原子大于1.5NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 可溶性碳酸盐与强酸反应生成CO2和H2O | |
| B. | 难溶的碳酸盐和难电离的酸反应生成CO2和H2O | |
| C. | 可溶性碳酸盐与任何酸溶液反应生成CO2和H2O | |
| D. | 石灰石和盐酸反应制取CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

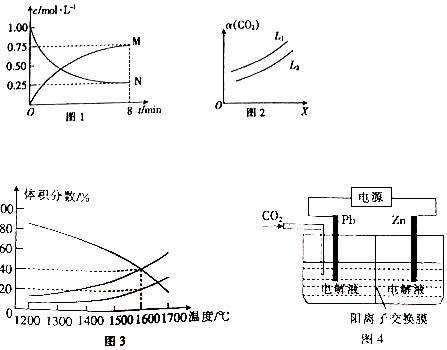
| A. | 图2 中反应速率最快的是容器丙 | |
| B. | 图1 中容器乙的反应可能使用了催化剂 | |
| C. | 图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=0.012mol/(L•min) | |
| D. | 图1 中容器丙内反应的平衡常数为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
| Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
| Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
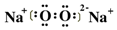 ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表
,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C14H18O6 | B. | 含有羟基、羧基和苯基 | ||
| C. | 能发生取代反应 | D. | 能使溴的水溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Tl+最外层有3个电子 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | 铊位于第五周期 IIIA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com