
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.糖类、油脂、蛋白质在一定条件都能发生水解反应
B.苯只能发生取代反应,不能发生加成反应
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.溴乙烷与NaOH的乙醇溶液共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 ___________________ 。

(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ • mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ • mol-1
则反应CO(g) + O2(g)=CO2(g)的 △H= kJ • mol-1。
O2(g)=CO2(g)的 △H= kJ • mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,
2NH3(g) △H<0,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项最后的物质是要制取的物质,其中能够得到的是
A.CaCO3  CaO
CaO  Ca(OH)2
Ca(OH)2  NaOH溶液
NaOH溶液
B. Cu CuO
CuO CuSO4溶液
CuSO4溶液 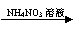 Cu(NO3)2溶液
Cu(NO3)2溶液
C.KMnO4 O2
O2 SO3
SO3  H2SO4
H2SO4
D .NH3  NO
NO  NO2
NO2  HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:

天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。

请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:( )
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学—物质结构与性质(15分)
化学—物质结构与性质(15分)
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如图所示),
但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个
方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-
数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。
Cu+基态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈
分子中碳原子轨道杂化类型是______;分子中处于同一
直线上的原子数目最多为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,.称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是 mo1;碳元素的质最是 g。
(2)维生素C中 (填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知 。
如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为 mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是 。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有 (填“酸”、“碱”或“中”)性。
查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com