
【题目】碱金属是典型的活泼金属,其根本原因是( )
A.碱金属原子最外电子层上都只有1个电子,容易失去
B.碱金属在常温下易被氧化
C.碱金属单质的密度小,熔点和沸点低
D.碱金属原子的核电荷数比较小
科目:高中化学 来源: 题型:
【题目】下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。
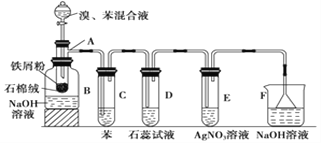
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): ;
(2)试管C中苯的作用是 ,反应开始后,观察D试管,看到的现象为
(3)在上述整套装置中,具有防倒吸作用的仪器有 (填字母)。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据2012年8月10日出版的英国《自然》杂志报道,科学家用DNA制造出一种臂长只有7nm的纳米(1nm=10-9m)级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
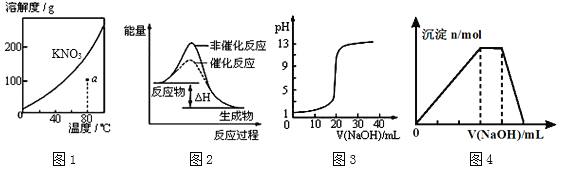
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. MgSO4= Mg+2+ SO42- B. Ba(OH)2= Ba2++ OH-
C. A12(SO4)3= 2A13++ 3 SO42- D. KClO3= K++ Cl-+ 3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学--选修3物质结构与性质】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如图所示.

①在1个晶胞中,X离子的数目为 .
②该化合物的化学式为 .
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 .
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 .
(4)Y与Z可形成YZ42﹣
①YZ42﹣的空间构型为 (用文字描述).
②写出一种与YZ42﹣互为等电子体的分子的化学式: .
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com