
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
【答案】I、(1)最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色
(2)0.015mol/L(3)丙
(4)CEII、不能;H3BO3+H2O![]() B(OH)4-+H+。Ⅲ、1×10-13
B(OH)4-+H+。Ⅲ、1×10-13
【解析】
试题分析:I、滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,即酚酞在酸中为无色,在碱性溶液中显浅红色,故答案为:最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;(2)舍去误差较大的数,得出V(标准)=(23.06+22.96)/2=23.01 mL,c(待测)= c(标准)×V(标准)/ V(待测)=(0.1×23.01)/20==0.115mol/L;(3)排除碱式滴定管尖嘴中气泡的方法应把胶管向上弯曲一定角度,然后轻轻挤压玻 璃球使尖嘴部分 充满碱液。丙对。(4)A.酸式滴定管使用前,水洗后未用待测盐酸润洗,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)公式分析,可知c(标准)偏小,A错误; B.锥形瓶洗涤后不干燥,对结果无影响,B错误; C.称量NaOH固体时,有小部分NaOH潮解,以酚酞为指示剂时等质量的氢氧化钠和潮解的氢氧化钠消耗的氢氧化钠后者大,所以造成V(标准)偏大,C正确; D.滴定终点读数时俯视读,造成V(标准)偏小,根据c(待测)公式分析,可知c(标准)偏小,D错误; E.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)公式分析,可知c(标准)偏大,E正确;
II、根据题意:强酸制备弱酸规律,H3BO3的电离常数为5.8×10-10,而K1=4.4×10-7、碳酸的酸性大于硼酸,所以不能观察到气泡。H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-信息,说明,H3BO3为一元弱酸,电离方程式:H3BO3+H2O![]() B(OH)4-+H+ ;
B(OH)4-+H+ ;
Ⅲ、0.01 mol/L的NaOH溶液,pH为11,C(H+)=10-11,C(OH-)=0.01 ;所以根据公式:C(H+)×C(OH-)=KW,
10-11,×0.01=1×10-13


科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)KOH的电子式:___,CH(CH3)3的名称为:______.
(2)有五种物质:①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是___(填序号,下同),非电解质是___.
(3)钠与水反应的化学方程式为:____________.
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
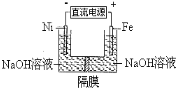
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自右向左移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
A.原子半径:Sr>Ca
B.最高化合价为+2
C.8838Sr的中子数为38
D.氢氧化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. “84”消毒液可用作漂白剂 B. 过氧化钠可用作供氧剂
C. 医院常用90%的酒精作消毒剂 D. 活性铁粉可用作抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高空中有一层臭氧层,它吸收太阳了太阳光中绝大部分紫外线,使地球上的生物免受紫外线伤害,臭氧的化学式是O3,它是一种
A. 混合物 B. 氧化物 C. 单质 D. 化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属是典型的活泼金属,其根本原因是( )
A.碱金属原子最外电子层上都只有1个电子,容易失去
B.碱金属在常温下易被氧化
C.碱金属单质的密度小,熔点和沸点低
D.碱金属原子的核电荷数比较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2单质的性质,设计如图所示装置进行实验.装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.

(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是: ;
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是: ;
(3)装置Ⅱ的作用是 ;
(4)实验过程中,装置Ⅳ中的实验现象为 ;发生反应的化学方程式为 ;
(5)实验结束后,该组同学在装置Ⅲ中观察b的红色退去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一目的,你认为应在 之间还需添加洗气瓶(选填装置序号),该装置的作用是 ;
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com