
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
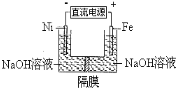
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自右向左移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
【答案】D
【解析】
试题分析:A、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe-6e-+8OH-═FeO42-+4H2O,故A错误;B、阴离子交换膜只允许阴离子通过;阴离子移向阳极,应从左向右移动,故B错误;C、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极,故C错误;D、阳极区域,铁失电子消耗氢氧根离子,溶液PH减小,阴极区氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,溶液PH增大;生成氢氧根离子物质的量消耗,在阳极电极反应Fe-6e-+8OH-═FeO42-+4H2O,阴极氢氧根离子增大,电极反应2H++2e-=H2↑,依据电子守恒分析,氢氧根离子消耗的多,生成的少,所以溶液pH降低,故D正确;故选D。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
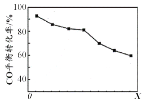
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程:
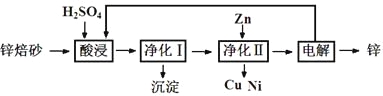
(1)酸浸时需要240 mL 4 mol·L-1稀H2SO4,用18.4 mol·L-1浓硫酸配制该稀H2SO4过程
中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。
(2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。
(3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。
(4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。
(5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。
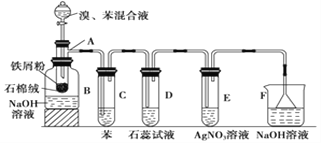
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): ;
(2)试管C中苯的作用是 ,反应开始后,观察D试管,看到的现象为
(3)在上述整套装置中,具有防倒吸作用的仪器有 (填字母)。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com