
【题目】按要求完成下列各题:
(1)KOH的电子式:___,CH(CH3)3的名称为:______.
(2)有五种物质:①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是___(填序号,下同),非电解质是___.
(3)钠与水反应的化学方程式为:____________.
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:__________________.
【答案】 ![]() 2﹣甲基丙烷 ② ⑤ 2Na+2H2O=2NaOH+H2↑ 2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O
2﹣甲基丙烷 ② ⑤ 2Na+2H2O=2NaOH+H2↑ 2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O
【解析】(1)氢氧化钾是离子化合物,其电子式为![]() ,CH(CH3)3的最长碳链为3个,名称为2﹣甲基丙烷;
,CH(CH3)3的最长碳链为3个,名称为2﹣甲基丙烷;
(2)①Cu是金属单质能导电,但单质既不是电解质也不是非电解质;②H2CO3是弱酸,是弱电解质;③BaSO4是盐,属于强电解质;④盐酸是氯化氢的水溶液,属于混合物,混合物既不是于电解质也不是非电解质;⑤SO2的水溶液能导电,但属于非电解质;故其中弱电解质有②,非电解质有⑤;
(3)钠与水反应生成氢氧化钠和氢气,其化学方程式为:2Na+2H2O=2NaOH+H2↑;
FeSO4溶液在酸性条件下被NaClO氧化生成铁盐溶液,其离子方程式为:2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】游泳池的水变绿主要是因为细菌及藻类的急剧繁殖导致的。
(1)含氯物质可以作为游泳池的消毒剂。一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖。
①露天游泳池水由于连续下雨和高温(28~30℃)会导致藻类大量繁殖,其原因是_____________。
②消毒剂的错误使用也会导致藻类大量繁殖,游泳池水变绿。若水中的余氯以次氯酸形式存在,再加入H2O2进行消毒也会导致池水变绿,写出次氯酸与H2O2发生反应生成盐酸的化学方程式_________________。
(2)处理池水变绿的方法分为五步。
①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡;CuSO4溶液也能够杀菌,其原理是_________。加入CuSO4溶液后需要打开水循环系统,其作用是_____________。
②含氯消毒剂杀菌消毒主要体现出的化学性质是_____________。
③选用Na2CO3调节pH至7.5,用化学用语和文字解释其原因_____________。
④聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出。稀释聚合氯化铝会产生胶体,其离子反应方程式是_____________;当温度大于80℃时,水体中铝离子的总浓度会降低,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol·L1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是
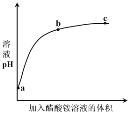
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH![]() H+ + CH3COO-逆向移动的结果
H+ + CH3COO-逆向移动的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 按系统命名法, ![]() 的名称为2,6二甲基5乙基庚烷
的名称为2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脱水,最多可生成4种二肽
C. 化合物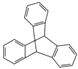 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.某ⅡA族元素的原子序数为a,则原子序数为a+1的元素一定是ⅢA族元素
B.除短周期外,其他周期均有32种元素
C.原子最外层只有2个电子的元素可能是金属元素也可能是非金属元素
D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
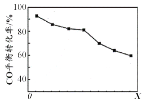
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com