
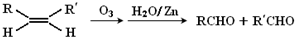

| 84×85.71% |
| 12 |
| 84-12×6 |
| 1 |
| 84×85.71% |
| 12 |
| 84-12×6 |
| 1 |
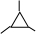 ,故答案为:
,故答案为: ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| B、化学反应 2Na2O2+2H2O=4NaOH+O2↑不属于四种基本反应类型但属于氧化还原反应 |
| C、将过量的二氧化锰与20mL12 mol?L-1的盐酸混合加热,充分反应后生成氯气的物质的量为0.06mol |
| D、碘化银可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O=Ca(OH)2 | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、98 | B、116 |
| C、158 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
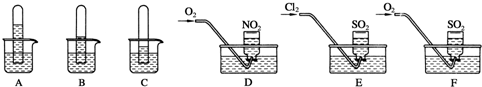
查看答案和解析>>
科目:高中化学 来源: 题型:
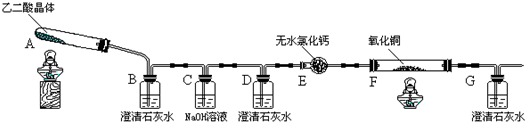
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 | |
| 滴定管 液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
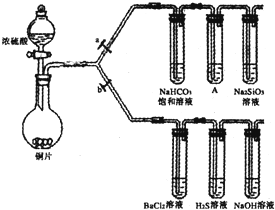
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com