
【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) === 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) ===H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆)_____υ(正)(填“>”或“<”)
②若改变条件使之从Y点到X点,则改变条件可以是___________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(I)和(II)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=________;实验温度T1_____T2(填“>”、“<”);催化剂的催化效率:实验①________实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为____________

【答案】CH3OH(l)+ O2(g) =CO(g) + 2H2O(l); ΔH=﹣442.8 kJ∕mol > 缩小体积增压 7.0×10-5 mol·L-1 min-1 < < 6Co3++CH3OH+H2O===6Co2++CO2↑+6H+
【解析】
(1)据已知反应利用盖斯定律解答;
(2) ①600K时Y点甲醇转化率大于X点甲醇平衡转化率;
②随压强增大,平衡向逆反应方向移动,甲醇转化率减小;
(3) 根据反应速率![]() 来计算;根据温度对化学平衡移动的影响知识来回答;催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
来计算;根据温度对化学平衡移动的影响知识来回答;催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
(4)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可以知道,还原生成H+,配平书写为: 6Co3++CH3OH+H2O===6Co2++CO2↑+6H+。
(1)已知① 2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) === 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) ===H2O(l) ΔH=-44.0 kJ/mol
据盖斯定律,(①-②+③![]() 4)
4)![]() 2得: CH3OH(l)+ O2(g) =CO(g) + 2H2O(l); ΔH=﹣442.8 kJ∕mol,
2得: CH3OH(l)+ O2(g) =CO(g) + 2H2O(l); ΔH=﹣442.8 kJ∕mol,
因此,本题正确答案是: CH3OH(l)+ O2(g) =CO(g) + 2H2O(l); ΔH=﹣442.8 kJ∕mol;
(2) ①600K时,Y点位于曲线的上方,要达到平衡状态,转化率降低,这说明反应向逆反应方向移动,所以甲醇的υ(逆)> υ(正),
因此,本题正确答案是:>;
②因为正方应是体积增大的可逆反应,则从Y点到X点可采取的措施是缩小体积增压,
因此,本题正确答案是:缩小体积增压;
(3) 实验(1)前20 min的平均反应速率υ(H2)=![]() =
=![]() =7.0×10-5 mol·L-1 min-1;
=7.0×10-5 mol·L-1 min-1;
实验温度越高达到化学平衡时甲醇转化率越大,②和③相比,③转化率高所以T1<T2;②与①化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,②中甲醇的浓度变化比①快;
因此,本题正确答案是:7.0×10-5 mol·L-1 min-1;<;<;
(4) 电解池中阳极失去电子,发生氧化反应,则Co2+在阳极的电极反应式为Co2+-e-=Co3+。Co3+将甲醇氧化成CO2和H+,而自身被还原为Co2+,所以反应的离子方程式为:6Co3++CH3OH+H2O===6Co2++CO2↑+6H+;
因此,本题正确答案是: 6Co3++CH3OH+H2O===6Co2++CO2↑+6H+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关反应和反应类型不相符的是
A. 苯与浓硝酸、浓硫酸混合加热制取硝基苯(取代反应)
B. 在一定条件下,苯与氯气生成六氯环己烷(加成反应)
C. 由乙炔(![]() )制取氯乙烯(CH2=CHCl) (氧化反应)
)制取氯乙烯(CH2=CHCl) (氧化反应)
D. 在催化剂的作用下由乙烯制取氯乙烷(加成反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
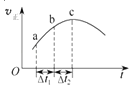
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于b点
C.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D.反应在c点达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,人利用反应
C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。
=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,试回答:
(1)反应中氧化剂和还原剂的物质的量之比是_____;
(2)当转移1 mol电子时,被氧化的Cl2的物质的量是___;
(3)每产生1 mol O2时,被氧元素还原的Cl2的物质的量是_____;
(4)反应消耗的水是(_____)
A.全部被氧化 B.全部被还原 C.![]() 被氧化 D.
被氧化 D.![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4mol/L的浓硫酸配制100mL浓度为1mol/L的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、__________、___________。
(2)其操作步骤可分解为以下几步:
a.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
b.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
c.将稀释后的硫酸小心地用玻璃棒引流容量瓶里
d.检查100mL容量瓶,是否漏水
e.将蒸馏水直接加入容量瓶,至液面接近刻度线______________
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液
g.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):( )→( )→( )→( )→( )→( )→(______)。
③进行A步操作后,选用量筒的规格是_______。
a.10mL b.50mL c.100mL d.1000mL
④如果对装有浓硫酸的量筒仰视读数,配制的稀硫酸浓度将_____(填“偏高”、“偏低”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应H2(g)+I2(g)![]() 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A. H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,不同物质表示的正、逆反应速率一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com