
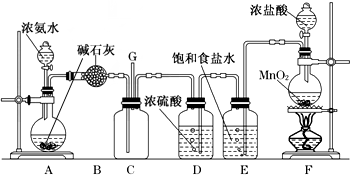
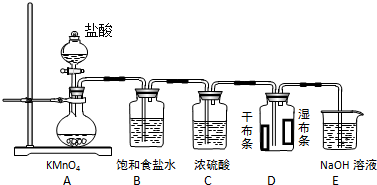
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)熟悉装置的形状,说出其名称;
(3)浓盐酸易挥发,制备的氯气含有氯化氢,依据氯气、氯化氢在饱和食盐水溶解度判断E的作用;
(4)氯气与氨气反应生成氯化铵固体和氮气;
(5)氯气有毒,直接排放容易引起环境污染,能够与氢氧化钠反应生成氯化钠、次氯酸和水,所以可以用氢氧化钠溶液吸收氯气;
(6)①依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
②利用MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O,依据生成氯气的物质的量计算即可.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B装置的名称是球形干燥管;
故答案为:球形干燥管;
(3)浓盐酸易挥发,制备的氯气含有氯化氢,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可以用E除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(4)氯气与氨气反应生成氯化铵固体和氮气,化学方程式:3Cl2+8NH3═N2+6NH4Cl;
故答案为:3Cl2+8NH3═N2+6NH4Cl;
(5)氯气有毒,直接排放容易引起环境污染,能够与氢氧化钠反应生成氯化钠、次氯酸和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,所以可以用氢氧化钠溶液吸收氯气;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)①质量分数36.5%(密度为1.14g/mL)盐酸的物质的量浓度c=$\frac{1000×1.14×36.5%}{36.5}$=11.4mol/L;
故答案为:11.4mol/L;
②标况下Cl22.24L,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O可知,n(MnO2)=n(C12),则消耗的质量为0.1mol×87g/mol=8.7g,
故答案为:8.7 g.
点评 本题考查了氯气的制备和性质的检验,有关物质的量的计算,熟悉氯气制备原理和氯气性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
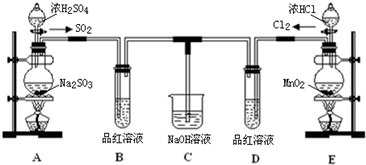
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
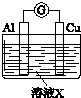 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
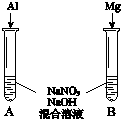 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com