
����Ŀ���������ũҩ�˰�������Ҫ�м��壮��ϳ�·�����£� 
��1��A���ʺ˴Ź��������и������շ�ķ����֮��Ϊ �� B��C�ķ�Ӧ������ �� E�к��������ŵ������� �� 1molD����������molNaOH��
��2����֪X�ķ���ʽΪC4H7Cl��д��A��B�Ļ�ѧ����ʽ�� ��
��3��Y��X��ͬ���칹�壬��������֧���Ҳ���������Y������ȥ��Ӧ���ò�������ƣ�ϵͳ�������� ��
��4�������йػ�����C��D��˵����ȷ���� �� �ٿ����Ȼ�����Һ����C��D
��C��D���еĹ�������ȫ��ͬ
��C��D��Ϊͬ���칹��
��C��D����ʹ��ˮ��ɫ
��5��E�ж���ͬ���칹�壬д��������������������ͬ���칹��Ľṹ��ʽ �� �����ڷ����廯����
�ڱ����ϵ�һ�ȴ���ֻ��һ��
�ۺ�������
���ܷ���������Ӧ��
���𰸡�
��1��1��1��1��ȡ����Ӧ���ǻ����Ѽ���3
��2��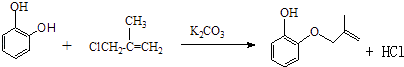
��3��1��3������ϩ
��4���٢ۢ�
��5��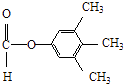 ��
�� 
���������⣺��1��A����Ϊ�Գƽṹ�������к���3����ԭ�ӣ���˴Ź���������3�����շ壬����֮��Ϊ1��1��1�������Գƣ����Ա�B��C�Ľṹ��֪��B�зө�OH�ϵ�H��ȡ����B��C�ķ�Ӧ����ȡ����Ӧ����E�Ľṹ��֪�����еĹ��������ǻ����Ѽ���D���б�����̼̼˫�������ܺ��������Ʒ�����Ӧ�����з��ǻ��ܺ���������1��1��Ӧ����ѡ�ܣ����Դ��ǣ�1��1��1��ȡ����Ӧ���ǻ����Ѽ���3����2���Ա�A��B�Ľṹ����֪A��B����ȡ����Ӧ����XΪCH2=CH��CH3��CH2Cl����Ӧ����HCl���ɣ���Ӧ����ʽΪ�� 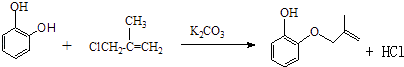 �����Դ��ǣ�
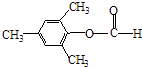
�����Դ��ǣ� 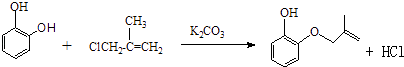 ����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ��
����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ�� 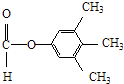 ��
�� 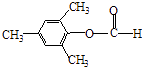 �����Դ��ǣ�
�����Դ��ǣ�  ��
��  ��
��


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ��MgO��SiO2��ɣ���������Fe2O3��FeO��Al2O3�����ʣ�����������������þ�Ĺ���������ͼ��ʾ�� 
��֪ijЩ�������������pH���±���ʾ��
�������� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Mg��OH��2 | 9.3 | 10.8 |
Fe��OH��2 | 7.6 | 9.6 |
Fe��OH��3 | 2.7 | 3.7 |
��1��MgO�ĵ���ʽΪ ��
��2������2����Ҫ�ɷ��� �� ������2�м������������NaOH��Һ��������Ӧ�����ӷ���ʽΪ ��
��3������NaOH������ҺpH=12.0ʱ��������Ӧ�����ӷ���ʽΪ ��
��4������Mg��OH��2�뺬SO2��������Ӧ����MgSO4 �� ����ʹ�������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5����ȡa������Ϊԭ�ϣ����õ�b��Mg��OH����Ʒ����������������þԪ������ʧ������������MgO����������Ϊ���ú���a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������YX2��ZX2�У�X��Y��Z�ĺ˵����С��18��Xԭ�������ܲ��p�ܼ�����һ�����������2�����ӣ�Yԭ�ӵ��������p�ܼ��ĵ���������ǰһ�ܲ������������X��Y������ͬ�ĵ��Ӳ㣻Z��X�����ڱ���λ��ͬһ���壮�ش��������⣺
��1��X�ĵ����Ų�ʽΪ �� Y�ĵ����Ų�ͼΪ��
��2��ZX2�ķ���ʽ�� �� YX2����ʽ����
��3��Y��Z�γɵĻ�����ķ���ʽ�� �� �û������л�ѧ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����Ԫ�أ�����A��Bԭ�Ӷ���1��δ�ɶԵ��ӣ�A+��B����һ�����Ӳ㣮Bԭ�ӵ�һ����������3p�����3p����ѳ�����Cԭ�ӵ�p�������3��δ�ɶԵ��ӣ�����̬�⻯���ˮ��Һ��pH��ͬ���⻯�������D������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ4��������������к�D 40%����������������������������ݴ��жϣ�
��1��A�� �� B�� �� C�� �� D�� �� ����Ԫ�ط��ţ�
��2��B���ĵ����Ų�ʽ �� A+�Ľṹʾ��ͼ ��
��3����A��B��D����Ԫ�صļ������У��뾶��С���� �� �����ӻ�ԭ����ǿ���� �� �������ӷ��ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A��B��C��D��E������A��Cԭ�Ӷ�������δ�ɶԵĵ����ӣ�D�Ķ�����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ�� B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ��������������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣨����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ��
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ ��
��2��B���⻯��ķ��ӿռ乹���� �� ������ԭ�ӵ��ӻ���ʽ�� ��
��3��AC2�ĵ���ʽ �� �����ӣ�����ԡ��Ǽ��ԡ�����һ����B��C��ɵĻ�������AC2��Ϊ�ȵ����壬�仯ѧʽΪ
��4��E�ĺ�������Ų�ʽ�� �� ECl3��B��C���⻯���γɵ������Ļ�ѧʽΪ ��
��5��B������������Ӧ��ˮ�����ϡ��Һ��D�ĵ��ʷ�Ӧʱ��B����ԭ����ͼۣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.1 mol OD�����Ӻ��е����ӡ���������Ϊ10NA
B.��״���£�4.48 L���麬�еķ�����Ϊ0.2NA
C.��״���£�6.72LNO2��ˮ��Ӧ���ĵ�������������Ϊ0.2NA
D.��ϩ�ͻ�������ɵ�42 g�����������ԭ�ӵĸ���Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��3CH4��g��+2N2��g��3C��s��+4NH3��g����H��0��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[ ![]() ]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� ��
]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� �� 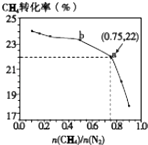
A.![]() Խ��CH4��ת����Խ��
Խ��CH4��ת����Խ��
B.![]() ����ʱ�������£�NH3���������������
����ʱ�������£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ26%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��������ͼװ�òⶨij���Ṥ���ŷ�β���ж�������ĺ�����ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ������ĵ�ˮ����ͨ��ʵ��ⶨSO2�ĺ�������ϴ��ƿC����Һ��ɫ�պ���ʧʱ�������رջ���A��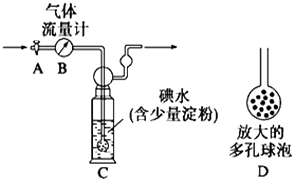
��1��C�е���ĩ������һ���������D���������� �� �������ʵ���ȷ�ȡ�
��2��C�з�����ӦΪSO2 + I2 +2H2O = H2SO4+ 2HI , I2 ��������������ԭ������
��3��ijͬѧ���ݷ�Ӧ��SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl�������һ��ʵ�飬�Ƚ�SO2��Fe2+ ��ԭ�Ե�ǿ��:ȡ����C����Һ���Թ��У��μ�2mL�Ȼ�����Һ��ҡ�ȣ����뼸��KSCN��Һ����Һ�����ɫ �����Լ���ѡ,�����Ʋ��衢����ͽ��ۣ���
��4���� ��������B�иպ�ͨ��2Lβ��ʱ��C����Һ��ɫ�պ���ʧ�������رջ���A������C��ǡ�õõ�100mL��Һ��������Һȫ��ת������ƿ�У��������BaCl2��Һ�����ˡ�ϴ�ӡ�����õ�4.66g ��ɫ������ͨ�������֪������β���ж�������ĺ���Ϊg/L�� �����ԭ������: Ba-137 S-32 O-16��
�� ��ϴ��ƿC����Һ��ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2����(�ƫ�ߡ�����ƫ�͡�����Ӱ�족).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+ �� ���ֺ�̽���������¡��������ữ��0.05mol��L-1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ��������������֤����ɫ�����к��С�
��ȡ�ϲ���Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵����Һ�к�����
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ���У�����Ϊ���۹���ʱ�������У������ݵ�ԭ�����������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⡣ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3 minʱ��С����Һ��ɫ��3 minʱ���� |
�� | 120 | ������ɫ��������30 minʱ��С����Һ��ɫ��3 0minʱ��dz |
�����ϣ�Ag+��SCN-���ɰ�ɫ����AgSCN��
�ڶ�Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2 �� �����������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3-���������ԣ��ɲ���Fe3+��
����d�����������ж���Һ�д���Ag+ �� �ɲ���Fe3+��
������ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ����Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3 minʱ��Һ��dz��ɫ��3 0min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ�� �� ������������
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡~����Fe3+Ũ�ȱ仯��ԭ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com