
【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示: 
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 .
(2)滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).
【答案】
(1)![]()
(2)Fe(OH)3、Al(OH)3;Al(OH)3+OH﹣═AlO2﹣+2H2O
(3)Mg2++2OH﹣═Mg(OH)2↓
(4)2Mg(OH)2+2SO2+O2═2MgSO4+2H2O
(5)![]()
【解析】解:硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质,加入硫酸,MgO、Fe2O3、FeO、Al2O3都和硫酸反应,MgO+H2SO4═MgSO4+H2O,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,FeO+H2SO4═FeSO4+H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,SiO2不与硫酸反应,滤渣1为SiO2 , 过氧化氢具有氧化性,加入的过氧化氢可把亚铁离子氧化成铁离子,H2O2+2Fe2++2H+═2Fe3++2H2O;
加入氢氧化钠,溶液pH升高,调PH=6.0,铁离子生成氢氧化铁沉淀,Fe3++3OH﹣═Fe(OH)3↓;
铝离子和氢氧根离子形成氢氧化铝沉淀,Al3++3OH﹣═Al(OH)3↓;过滤滤渣2为Fe(OH)3、Al(OH)3 ,
滤液中含镁离子,调节PH=12,Mg2++2OH﹣═Mg(OH)2↓;得到滤渣3:Mg(OH)2 , 洗涤烘干得到Mg(OH)2晶体.(1)MgO是离子化合物,由Mg2+离子和O2﹣离子构成,MgO的电子式 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)加入氢氧化钠,溶液pH升高,调PH=6.0,铁离子生成氢氧化铁沉淀,Fe3++3OH﹣═Fe(OH)3↓;铝离子和氢氧根离子形成氢氧化铝沉淀,Al3++3OH﹣═Al(OH)3↓;过滤滤渣2为Fe(OH)3、Al(OH)3 , 氢氧化铝具有两性,向滤渣2中继续加入过量的NaOH溶液,发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,
;(2)加入氢氧化钠,溶液pH升高,调PH=6.0,铁离子生成氢氧化铁沉淀,Fe3++3OH﹣═Fe(OH)3↓;铝离子和氢氧根离子形成氢氧化铝沉淀,Al3++3OH﹣═Al(OH)3↓;过滤滤渣2为Fe(OH)3、Al(OH)3 , 氢氧化铝具有两性,向滤渣2中继续加入过量的NaOH溶液,发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,
所以答案是:Fe(OH)3、Al(OH)3;Al(OH)3+OH﹣═AlO2﹣+2H2O(3)滤液中含镁离子,调节PH=12,Mg2++2OH﹣═Mg(OH)2↓,所以答案是:Mg2++2OH﹣═Mg(OH)2↓;(4)氢氧化镁无氧化性,根据信息反应物为Mg(OH)2、SO2、产物为MgSO4 , 所以反应物必有O2 , 所以该反应为:2Mg(OH)2+2SO2+O2═2MgSO4+2H2O,
所以答案是:2Mg(OH)2+2SO2+O2═2MgSO4+2H2O;(5)设硼泥中MgO的质量分数为x,根据镁原子守恒: ![]() ,解得x=
,解得x= ![]() ,所以答案是:
,所以答案是: ![]() .
.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2 , 也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101 kPa,温度为0℃).
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 .
A.200mL
B.400mL
C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为: .
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是 .
(4)若在烧瓶中投入d g锌,再加入VL c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 ![]() =(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,
=(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管, ![]() 的比值将(填偏大、偏小或无影响)
的比值将(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )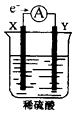
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42-向X极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为2L的密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
(1)实验1和实验2中使用了催化剂的实验是(填“1”或“2”);
(2)实验1中,010min内生成H2的平均反应速率为 molL﹣1min﹣1;
(3)实验3的反应达到化学反应限度时,HI(g)转化率为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A.98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B.当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1 , 只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C.只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
请回答下列问题:
(1)写出下列物质的结构简式:B , D;
(2)写出下列反应A→B的化学方程式 , 反应类型;
(3)写出下列反应C+E→F的化学方程式 , 反应类型 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产农药克百威的主要中间体.其合成路线如下: 
(1)A物质核磁共振氢谱中各组吸收峰的峰面积之比为 , B→C的反应类型是 , E中含氧官能团的名称是 , 1molD最多可以消耗molNaOH.
(2)已知X的分子式为C4H7Cl,写出A→B的化学方程式: .
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y发生消去反应所得产物的名称(系统命名)是 .
(4)下列有关化合物C、D的说法正确的是 . ①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式 . ①属于芳香族化合物
②苯环上的一氯代物只有一种
③含有酯基
④能发生银镜反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com