
ЎҫМвДҝЎҝПВБРёщҫЭКөСйІЩЧчәНПЦПуЛщөГіцөДҪбВЫІ»ХэИ·өДКЗ![]() ЎЎЎЎ
ЎЎЎЎ![]()
СЎПо | КөСйІЩЧч | КөСйПЦПу | ҪбВЫ |
A | ПаН¬ОВПВЈ¬Ів¶ЁөИЕЁ¶ИөДNaHCO3әНNaHSO4ИЬТәөДpH | З°ХЯpHұИәуХЯөДҙу | ·ЗҪрКфРФЈә |
B | Ҫ«ВБІӯФЪҫЖҫ«өЖЙПјУИИ | ВБІӯИЫ»ҜІўІ»өОВд | ИЫөгЈәAl2O3>Al |
C | Ҫ«өИЕЁ¶ИЎўөИМе»эөДKIәНFeCl3ИЬТә»мәПІўід·Ц·ҙУҰәуЈ¬өОјУKSCNИЬТә | ИЬТәіцПЦСӘәмЙ« | Fe3+КЗ№эБҝөДЈ¬Ҫ« |
D | Ҫ«ұҘәНВИЛ®өОөҪА¶Й«КҜИпКФЦҪЙП | КФЦҪПИұдәмәуНКЙ« | ВИЛ®ҫЯУРЛбРФәНЗҝСх»ҜРФ |
A. AB. BC. CD. D
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
A. NaHCO3Л®ҪвПФјоРФЈ¬NaHSO4ИЬТәөзАлПФЛбРФЈ¬ФтБтЛбөДЛбРФҙуУЪМјЛбЈ¬·ЗҪрКфРФЈәS>CЈ¬ AХэИ·Ј»
B.Сх»ҜВБөДИЫөгёЯЈ¬°ь№ьФЪAlөДНвГжЈ¬ФтВБІӯИЫ»ҜІўІ»өОВдЈ¬№КBХэИ·Ј»
C.өИОпЦКөДБҝөДKIәНFeCl3ИЬТә·ўЙъСх»Ҝ»№Фӯ·ҙУҰЙъіЙөвөҘЦКЈ¬УЙПЦПуҝЙЦӘЈ¬»№ҙжФЪМъАлЧУЈ¬ФтёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬І»ДЬНкИ«ЧӘ»ҜЈ¬CҙнОуЈ»
D.ВИЛ®ЦРә¬HClOЈ¬ҫЯУРЖҜ°ЧРФЈ¬ФтА¶Й«КҜИпКФЦҪПИұдәмәуНКЙ«Ј¬DХэИ·Ј»
№КәПАнСЎПоКЗCЎЈ


 ББөгјӨ»оҫ«ұаМбУЕ100·ЦҙуКФҫнПөБРҙр°ё
ББөгјӨ»оҫ«ұаМбУЕ100·ЦҙуКФҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪьДкАҙЈ¬ОнцІМмЖш¶аҙОЛБЕ°И«№ъёчөШЎЈЖдЦРЈ¬ИјГәөДСМөАЖшәНЖыіөОІЖшЦРә¬УРөДөӘСх»ҜәПОпКЗФміЙҝХЖшОЫИҫөДФӯТтЦ®Т»ЎЈ
ЈЁ1Ј©УГCH4ҙЯ»Ҝ»№ФӯөӘСх»ҜОпЎЈТСЦӘCH4 (g)Ј«2O2 (g)ЈҪCO2 (g)Ј«2H2O (l);ҰӨH1ЈҪa kJ/molЈ¬УыјЖЛг·ҙУҰCH4 (g)Ј«4NO (g)ЈҪ2N2 (g)Ј«CO2 (g)Ј«2H2O (l)өДмКұдҰӨH2 Ј¬ Фт»№РиТӘІйХТДі»ҜәП·ҙУҰөДмКұдҰӨH3Ј¬өұ·ҙУҰЦРёчОпЦК»ҜС§јЖБҝКэЦ®ұИОӘЧојтХыКэұИКұ ҰӨH3 = b kJ/molЈ¬ФтёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪОӘ____________________ЎЈҫЭҙЛјЖЛгіцҰӨH2 =_______kJ/molЈЁУГә¬aәНbөДКҪЧУұнКҫЈ©ЎЈ
ЈЁ2Ј©УГ»оРФМҝ»№Фӯ·ЁҙҰАнөӘСх»ҜОпЎЈУР№Ш·ҙУҰОӘЈәC(s) + 2NO(g)![]() N2 (g) + CO2 (g) ҰӨHЎЈДіСРҫҝРЎЧйПтДіГЬұХИЭЖчјУИлТ»¶ЁБҝөД»оРФМҝәНNOЈ¬әгОВ(T1Ўж)МхјюПВ·ҙУҰЈ¬·ҙУҰҪшРРөҪІ»Н¬КұјдІвөГёчОпЦКөДЕЁ¶ИИзПВЈә
N2 (g) + CO2 (g) ҰӨHЎЈДіСРҫҝРЎЧйПтДіГЬұХИЭЖчјУИлТ»¶ЁБҝөД»оРФМҝәНNOЈ¬әгОВ(T1Ўж)МхјюПВ·ҙУҰЈ¬·ҙУҰҪшРРөҪІ»Н¬КұјдІвөГёчОпЦКөДЕЁ¶ИИзПВЈә
ЕЁ¶И/molЎӨLЈӯ1 Кұјд/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
ўЩ T1ЎжКұЈ¬ёГ·ҙУҰөДЖҪәвіЈКэK=___________ЈЁұЈБфБҪО»РЎКэЈ©ЎЈ
ўЪ 30 minәуЈ¬ёДұдДіТ»МхјюЈ¬·ҙУҰЦШРВҙпөҪЖҪәвЈ¬ФтёДұдөДМхјюҝЙДЬКЗ________________ЎЈ
ўЫ Иф30 minәуЙэёЯОВ¶ИЦБT2Ўж/span>Ј¬ҙпөҪЖҪәвКұЈ¬ИЭЖчЦРNOЎўN2ЎўCO2өДЕЁ¶ИЦ®ұИОӘ5:3:3Ј¬ФтёГ·ҙУҰөДҰӨH____________0ЈЁМоЎ°>ЎұЎўЎ°=Ўұ»тЎ°<ЎұЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ФҝЙДж·ҙУҰ4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)Ј¬ПВБРРрКцХэИ·өДКЗ
4NO(g) + 6H2O(g)Ј¬ПВБРРрКцХэИ·өДКЗ
A. »ҜС§·ҙУҰЛЩВК№ШПөКЗЈә2vХэЈЁNH3Ј© = 3vХэЈЁH2OЈ©
B. .ИфөҘО»КұјдДЪЙъіЙx mol NOөДН¬КұЈ¬ПыәДx mol NH3Ј¬Фт·ҙУҰҙпөҪЖҪәвЧҙМ¬
C. ҙпөҪ»ҜС§ЖҪәвКұЈ¬ИфФцјУИЭЖчМе»эЈ¬ФтХэ·ҙУҰЛЩВКјхРЎЈ¬Дж·ҙУҰЛЩВКФцҙу
D. ҙпөҪ»ҜС§ЖҪәвКұЈ¬4vХэЈЁO2Ј© = 5vДжЈЁNOЈ©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ2018Дк11ФВ3ИХёЈҪЁИӘЦЭёЫЗш·ўЙъМјҫЕР№В¶КВјюЎЈМјҫЕЦчТӘә¬ИэјЧұҪЎўТмұыұҪЎўХэұыұҪЎўТТ»щјЧұҪөИУР»ъОпЎЈПВБР№ШУЪМјҫЕЛө·ЁІ»ХэИ·өДКЗ![]() ЎЎЎЎ
ЎЎЎЎ![]()
A. МјҫЕКЗ¶аЦЦ·јПгМюөД»мәПОпЈ¬ҝЙНЁ№эКҜУНҙЯ»ҜЦШХыөГөҪ
B. ҪшИлМјҫЕөДР№В¶ЗшУҰЕеҙчә¬»оРФМҝөДҝЪХЦЈ¬ұЬГвОьИлУРәҰЖшМе
C. МјҫЕә¬ЙПКцЛДЦЦ·ЦЧУөД·ЦЧУКҪҫщОӘC9H12Ј¬ЛьГЗ»ҘОӘН¬·ЦТм№№Ме
D. МјҫЕә¬УРөДУР»ъОпҫщТЧИЬУЪЛ®Ј¬»бФміЙР№В¶ҙҰәЈУтСПЦШОЫИҫ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСОЛбАы¶аҝЁТт(F)ҝЙУГУЪјұРФРДјЎ№ЈИыәуКТРФФзІ«әНКТРФРД¶Ҝ№эЛЩЈ¬әПіЙВ·ПЯИзПВЈә

»ШҙрПВБРОКМвЈә
(1)AөД»ҜС§ГыіЖОӘ_________ЎЈ
(2)·ҙУҰўЩЛщРиКФјБЎўМхјю·ЦұрОӘ_________Ўў_________ЎЈ
(3)BөДН¬·ЦТм№№МеЦЦАаәЬ¶аЈ¬·ыәПТФПВМхјюөДBөДН¬·ЦТм№№Ме№ІУР_________ЦЦ(І»ҝјВЗБўМеТм№№)ЎўЖдЦР№ЩДЬНЕөДГыіЖКЗ_________ЎЈ
ўЩКфУЪұҪөДСЬЙъОпЈ¬ұҪ»·ЙП№ІУРИэёцИЎҙъ»щЈ»
ўЪУлМјЛбЗвДЖИЬТә·ҙУҰҝЙ·ЕіцCO2ЖшМеЎЈ
(4)CөДҪб№№јтКҪОӘ_________ЎЈ
(5)ClCH2COClУлЧгБҝNaOHИЬТә№ІИИід·Ц·ҙУҰөД»ҜС§·ҪіМКҪОӘ_________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПіЈІЙУГОьКХ-өзҪвБӘәП·ЁіэИҘМмИ»ЖшЦРөДH2SЖшМеЈ¬ІўЧӘ»ҜОӘҝЙ»ШКХАыУГөДөҘЦКБтЈ¬ЖдЧ°ЦГИзПВНјЛщКҫЎЈНЁөзЗ°Ј¬ПИНЁИлТ»¶ОКұјдә¬H2SөДјЧНйЖшЈ¬К№Іҝ·ЦNaOHОьКХH2SЧӘ»ҜОӘNa2SЈ¬ФЩҪУНЁөзФҙЈ¬јМРшНЁИлә¬ФУЦКөДјЧНйЖшЈ¬ІўҝШЦЖәГНЁЖшЛЩВКјҙҝЙұЈЦӨЧ°ЦГЦР·ҙУҰөДБ¬РшРФЎЈПВБРЛө·ЁХэИ·өДКЗ

A. УлөзФҙa¶ЛПаБ¬өДМј°фОӘСфј«Ј¬ЖшМеAОӘO2
B. УлөзФҙb¶ЛПаБ¬өДМј°фЙПөзј«·ҙУҰОӘЈә2H2O+2eЈӯ=2OHЈӯ+H2Ўь
C. НЁөз№эіМЦРЈ¬УТіШИЬТәЦРөДOHЈӯНЁ№эТхАлЧУДӨҪшИлЧуіШ
D. ФЪНЁөзЗ°әуЈ¬УТіШЦРөДc(NaOH)Улc(Na2S)Ц®ұИ»щұҫІ»ұд
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪәГСхҫъәНСбСхҫъЧчУГПВ·ПТәЦРNH4+ДЬЧӘ»ҜОӘN2(g)әНH2O(l)Ј¬КҫТвНјИзПВЈә
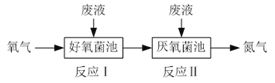
·ҙУҰIЈәNH4+(aq)Ј«2O2(g)=NO3Јӯ(aq)Ј«2H+(aq)Ј«H2O(l) ҰӨH1ЈҪa kJЎӨmolЈӯ1
·ҙУҰIIЈә5NH4+(aq)Ј«3NO3Јӯ(aq)=4N2(g)Ј«9H2O(l)Ј«2H+(aq) ҰӨH2ЈҪb kJЎӨmolЈӯ1
ПВБРЛө·ЁХэИ·өДКЗ
A. БҪіШ·ўЙъөД·ҙУҰЦРөӘФӘЛШЦ»ұ»Сх»Ҝ
B. БҪіШЦРН¶·ЕөД·ПТәМе»эПаөИКұNH4+ДЬНкИ«ЧӘ»ҜОӘN2
C. іЈОВіЈС№ПВЈ¬·ҙУҰIIЦРЙъіЙ22.4 L N2ЧӘТЖөДөзЧУКэОӘ3.75ЎБ6.02ЎБ1023
D. 4NH4+(aq)Ј«3O2(g)=2N2(g)Ј«4H+(aq)Ј«6H2O(l) ҰӨHЈҪ![]() (3aЈ«b) kJЎӨmolЈӯ1
(3aЈ«b) kJЎӨmolЈӯ1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§·ҙУҰ2A![]() BЈ«DФЪЛДЦЦІ»Н¬МхјюПВҪшРРЈ¬BЎўDЖрКјЕЁ¶ИОӘ0ЎЈ·ҙУҰОпAөДЕЁ¶ИЈЁmol/LЈ©Лж·ҙУҰКұјдЈЁminЈ©өДұд»ҜЗйҝцИзПВұнЈә
BЈ«DФЪЛДЦЦІ»Н¬МхјюПВҪшРРЈ¬BЎўDЖрКјЕЁ¶ИОӘ0ЎЈ·ҙУҰОпAөДЕЁ¶ИЈЁmol/LЈ©Лж·ҙУҰКұјдЈЁminЈ©өДұд»ҜЗйҝцИзПВұнЈә
КөСй | Кұ јд | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800Ўж | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800Ўж | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800Ўж | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820Ўж | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
ёщҫЭЙПКцКэҫЭЈ¬НкіЙПВБРМоҝХЈә
ЈЁ1Ј©ФЪКөСй1Ј¬·ҙУҰФЪ10ЦБ20·ЦЦУКұјдДЪЖҪҫщЛЩВКОӘ mol/ЈЁLЎӨminЈ©ЎЈ
ЈЁ2Ј©ФЪКөСй2Ј¬AөДіхКјЕЁ¶Иc2ЈҪ____________mol/LЈ¬·ҙУҰҫӯ20·ЦЦУҫНҙпөҪЖҪәвЈ¬ҝЙНЖІвКөСй2ЦР»№Тюә¬өДМхјюКЗ___________ЎЈ
ЈЁ3Ј©ЙиКөСй3өД·ҙУҰЛЩВКОӘv3Ј¬КөСй1өД·ҙУҰЛЩВКОӘv1Ј¬Фтv3_______v1ЈЁМоЈҫЎўЈҪЎўЈјЈ©Ј¬ЗТc3_______1.0 mol/LЈЁМоЈҫЎўЈҪЎўЈјЈ©ЎЈ
ЈЁ4Ј©ұИҪПКөСй4әНКөСй1Ј¬ҝЙНЖІвёГ·ҙУҰКЗ________·ҙУҰЈЁСЎМоОьИИЎў·ЕИИЈ©ЎЈАнУЙКЗ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«4molAЖшМеәН2molBЖшМеФЪ2 LөДИЭЖчЦР»мәПЈ¬ІўФЪТ»¶ЁМхјюПВ·ўЙъИзПВ·ҙУҰЈә2A(g)+B(g) ![]() 2C(g)ЎЈИфҫӯ2 sәуІвөГCөДЕЁ¶ИОӘ0.6molЎӨL-1Ј¬ПЦУРПВБРјёЦЦЛө·ЁЈә
2C(g)ЎЈИфҫӯ2 sәуІвөГCөДЕЁ¶ИОӘ0.6molЎӨL-1Ј¬ПЦУРПВБРјёЦЦЛө·ЁЈә
ўЩУГОпЦКAұнКҫөД·ҙУҰөДЖҪҫщЛЩВКОӘ0.3 molЎӨL-1ЎӨs-1 Ј»
ўЪУГОпЦКBұнКҫөД·ҙУҰөДЖҪҫщЛЩВКОӘ0.6 molЎӨL-1ЎӨs-1Ј»
ўЫ2sКұОпЦКAөДЧӘ»ҜВКОӘ30ЈҘ Ј»
ўЬ2sКұОпЦКBөДЕЁ¶ИОӘ1.4molЎӨLЈӯ1ЎЈ
ЖдЦРХэИ·өДКЗЈЁ Ј©
A. ўЩўЫ B. ўЩўЬ C. ўЪўЫ D. ўЫўЬ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com