
| A、8g | B、16g |
| C、24g | D、32g |
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
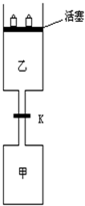 连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:
连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
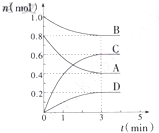 在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:
在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸钠溶液中滴加与其溶质的物质的量相等的盐酸:CO32-+2H+=CO2↑+H2O |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| D、向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁比纯铁更易生锈 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、银质奖章久置后易表面变暗 |
| D、海轮上一般会在吃水线下绑定一定量的锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com