
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 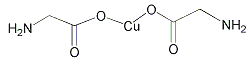 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
【答案】B
【解析】分析:知道配位键的成因;根据结构式分析σ键和π键的数目;用等电子原理分析分子结构;了解常见分子的结构。
详解:A. NH3分子中的N有孤电子对,H+和Cu2+都有空轨道,故在NH![]() 和[Cu(NH3)4]2+中都存在配位键,A正确;
和[Cu(NH3)4]2+中都存在配位键,A正确;
B. 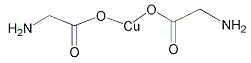 σ键和π键的数目分别为18和2,故其比例为9:1,B不正确;
σ键和π键的数目分别为18和2,故其比例为9:1,B不正确;
C. C![]() 与O
与O![]() 互为等电子体,故C
互为等电子体,故C![]() 与O
与O![]() 均含有叁键, 1 mol O
均含有叁键, 1 mol O![]() 中含有的π键数目为2NA,C正确;
中含有的π键数目为2NA,C正确;
D. N2分子中有叁键,叁键中有2个π键。已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,即消耗1mol N2H4,则生成1.5mol N2,形成的π键数目为3NA,D正确。
综上所述,说法错误的是B,本题选B。


科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙(由6个球体所围成的空隙。6个球体中心的连线连接成八面体形状),一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。
(1)镍的外围电子排布式为________________。
(2)画出该新型超导材料的一个晶胞。(镁原子处于晶胞的顶点。碳原子用▲球,镍原子用○球表示)_______。
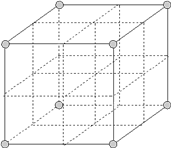
(3)写出该新型超导材料的化学式_____________。
(4)镍原子的配位数是_____________。
(5)原子坐标参数表示晶胞内部各原子的相对位置,用(0,0,0)表示镁原子的原子坐标,晶胞边长设为1,则碳原子的原子坐标参数为_____________。
(6)已知晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
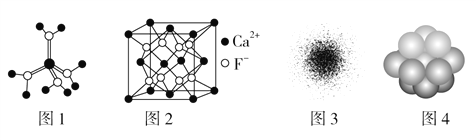
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是( )
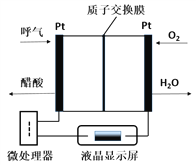
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com