
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
【答案】 三角锥 共用电子对多斥力大,键角大 平面三角形 4s24p5 > H-O-I sp3杂化 碘 D V形 Cl2O (或其他合理答案)
【解析】(1)根据ABm型分子的价电子对计算方法得:H3O+价电子对数=(6+1×3-1)÷2=4,其空间构型是正四面体,但参与成键的原子只有三个,所以受孤对电子的斥力影响,其结构是三角锥形; H2O中O原子有2孤对电子,H3O+中O原子只有1对孤对电子,排斥力较小,所以H3O+中H﹣O﹣H键角比H3O+中H﹣O﹣H键角大,正确答案:三角锥型 ;孤对电子对多斥力大,键角大;
(2)在COCl2结构中,成键电子对数=(4+2+0)/2=3 (碳是中心原子,提供4个价电子,卤素做配原子提供1个价电子,氧原子做配原子不提供价电子),等于3,中心原子无孤电子对,C与O原子之间形成C=O双键,碳原子是SP2杂化,其结构式是![]() ,所以它的空间构型为平面三角形所以;溴原子是35号元素,其核外电子排布式:1s22s22p63s23p63d104s24p5,所以溴的价电子排布式:4s24p5,正确答案:平面三角形;4s24p5;
,所以它的空间构型为平面三角形所以;溴原子是35号元素,其核外电子排布式:1s22s22p63s23p63d104s24p5,所以溴的价电子排布式:4s24p5,正确答案:平面三角形;4s24p5;
(3)成键原子得电子能力的差别越大,共用电子对偏移的程度越大,共价键的极性就越强,F的非金属性比O强,所以F原子得电子能够比O原子强,键的极性F-H 大于O-H,正确答案:> ;
(4)溴化碘是拟卤素,溴的非金属性比碘强,溴化碘与水反应类似与氯气与水反应,溴化碘与水反应的化学方程式为IBr+H2O=HBr+HIO,该分子的结构式:H-O-I,中心原子是O原子,H-O-I的结构可以看成是H-O-H中的一个H原子被I原子取代,所以O原子的杂化方式是:sp3杂化,正确答案:H-O-I;sp3杂化;
(5)卤族元素包含:F、Cl、Br、I元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,正确答案:碘;
(6)HCl中存在s-pσ键, HF中存在s-pσ键, SO2中存在p-pπ键, SCl2中存在p-pσ键,所以既不存在sp σ键,也不存在pp π键的是D选项,正确答案D;
(7)根据ABm型分子的价电子对计算方法得:ClO2-价电子对数=(7+2×0+1)÷2=4,是sp3杂化,其空间构型是正四面体,但参与成键的原子只有2个,所以其空间构型是V型;等电子体是指价电子数和原子数分别都相等的物质,ClO2-中价电子数是7+6×2+1=20,所以与其互为等电子体的是分子有Cl2O、OF2,正确答案:V型 ;Cl2O4;


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A. 3:1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质铝应用极为广泛,从铝土矿中提取铝主要分以下三个阶段,根据要求回答相关问题
(1)铝土矿的提纯:铝土矿主要成分是Al2O3(含有Fe2O3、SiO2等杂质),提纯流程如下图所示:
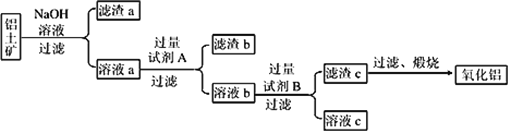
①在用NaOH溶液母液浸提过程中需研碎、湿磨,其目的是______________________________。
②向溶液a中通入过量CO2,所得不溶物煅烧后也可得Al2O3,该方法的缺点是___________________________________________________。
(2)制备无水氯化铝
其反应为:2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是_____________________________。
(3)电解制取铝
目前可低温电解AlCl3熔盐得到金属铝纯的无水氯化铝熔点190℃,沸点180℃,其导电性如图:
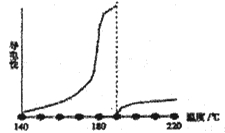
①从图中可知,AlCl3熔融液导电能力___________________________。
②但若在AlCl3中加入NaCl,使形成共融物,将AlCl3制成离子型液体,导电能力增强,熔融液中存在的阴离子是Cl-、AlCl4-、Al2Cl7-,请写AlCl3加入NaCl后形成离子型液体的两个离子方程式:AlCl3+ Cl-=AlCl4-、及平衡________________________________。
③电解时,阳极主要是AlCl4-放电,其电极反应为__________________________________。
④为保证电解进行,熔融液主要离子是AlCl4-、Al2Cl7-,则n(AlCl3)∶n(NaCl)应大于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于同一反应类型的是
A. 甲烷制一氯甲烷、苯制硝基苯
B. 苯制溴苯、乙烯制乙醇
C. 乙醇制乙醛、乙醇和乙酸制乙酸乙酯
D. 苯制环己烷、乙酸乙酯水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①﹣⑤中,既属于氧化还原反应又属于化合反应的是_____(填序号)
(2)反应⑤的化学方程式为_______________________________________
(3)甲与B反应的离子方程式________________________________________
(4)在实验室将C溶液滴入F溶液中,观察到的现象是____________________________________
(5)在F溶液中加入等物质的量的A,A体现的性质为_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《开宝本草》中记载了KNO3的提纯方法“……所在三泽,冬月地上有霜,打扫以水淋汁后,乃煎炼而成”,这里未涉及到的操作方法是
A.升华B.蒸发C.结晶D.溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
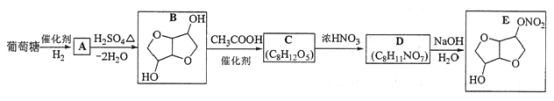
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 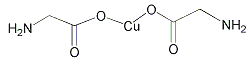 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com